COMPETÊNCIAS E HABILIDADES
Identificar matérias – primas empregadas e produtos obtidos em diferentes processos industriais.
Identificar a formação de novas substâncias a partir das evidências macroscópicas (mudanças de cor, desprendimento de gás, mudança de temperatura, formação de precipitado, emissão de Luz etc.).
Reconhecer a ocorrência de transformações químicas no dia a dia e no sistema produtivo.
Identificar formas e energia envolvidas nas transformações químicas.
Ler, descrever e compreender as transformações químicas em linguagem discursiva.
Reconhecer o estado físico dos materiais a partir de suas temperaturas de fusão e de ebulição.
Comparar o tempo necessário para que as transformações químicas ocorram (rapidez).
Trazer para a sala de aula informações sobre a situação do lixo no município e na escola, levando os alunos a discutir os problemas de sua comunidade para que ele possa tomar consciência do mundo em que está inserido. São introduzidos os conteúdos para a compreensão da tecnologia relacionada ao lixo. Esse conteúdo é essencial na medida em que contribui para a formação tecnológica do aluno.
TEMA: “TRANSFORMAÇÃO QUÍMICA NA NATUREZA E NO SISTEMA PRODUTIVO”
ATIVIDADE 1: PRODUÇÃO DE ETANOL
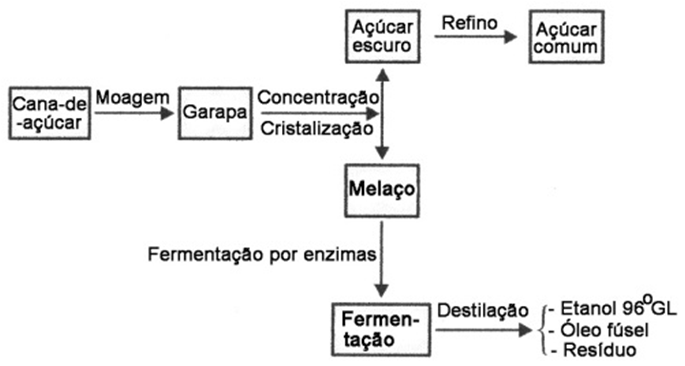
O etanol é o principal álcool de aplicação em nossa sociedade , chamado, muitas vezes, simplesmente de álcool. Os álcoois são uma função muito importante estudada em Química Orgânica. Entre as variedades e aplicações que ele apresenta, temos seu uso em bebidas alcoólicas, como combustível, em perfumes, tintas, vernizes, solventes e em soluções desinfetantes. Etanol pode ser produzido a base de qualquer matéria-prima que possua sacarose ou amido (açúcar). O etanol é obtido através do processo de fermentação e pode-se usar diversas matérias-primas, como a cana de açúcar, beterraba, milho entre outros. Essas matérias-primas são moídas para obtenção de caldos, os quais são aquecidos para se concentrar o açúcar presente no mesmo. Após isso são misturados com microorganismos, normalmente, leveduras, que irão usar esse açúcar presente no caldo para se alimentar produzindo como produto o álcool etílico. O principal método de produção do álcool é por meio da fermentação do melaço da cana-de-açúcar. Essa fermentação é realizada por micro-organismos, principalmente leveduras da espécie Saccharomyces cerevisae, que, na presença da sacarose (açúcar), o processo de fermentação alcoólica do mosto: a enzima (invertase), encontrada nas leveduras (Saccharomyces cerevisiae), que são adicionadas ao mosto, converte a sacarose (C12H22O11) em glicose (C6H12O6) e em frutose (C6H12O6), que por meio da ação da outra enzima (zimase), também presente na levedura, são transformadas em etanol (C2H5OH) e gás carbônico (CO2), com a liberação de energia térmica. Após isso, essa mistura passa por um processo de destilação até a obtenção da concentração do etanol desejada. Essas transformações são representadas pelas seguintes equações:


1.A – Em relação ao processo de produção de etanol, discuta com seus colegas as seguintes questões:
- Qual é a matéria-prima utilizada para a produção de etanol?
- Como o etanol é obtido? Qual o nome do processo?
- É possível produzir etanol utilizando diferentes matérias-primas?
- Qual a importância da produção de etanol para o Brasil?
- Quais vantagens o Brasil tem em relação aos outros países sobre o custo de produção de etanol?
1.B – Após a discussão, registre as suas ideias e hipóteses, com relação a cada situação-problema (questão).
1.C – Assista aos vídeos a seguir sobre a produção de etanol e reflita sobre os aspectos envolvidos, desde o plantio da cana-de-açúcar, colheita, transporte até a indústria e processa-mento. Na sequência, realize o resumo das principais ideias dos vídeos, socialize com os colegas e registre no seu caderno.
I. De onde vem o etanol? Como é o plantio da cana?
Etanol Sem Fronteira – episódio 1. Disponível em:
II. O que muda com a tecnologia no campo? Etanol Sem Fronteira – episódio 2. Disponível em:
III. Como a cana-de-açúcar vira etanol? Etanol Sem Fronteira – episódio 3. Disponível em:
1.D – Com a orientação do seu professor, realize o experimento: “Fermentação alcoóli-ca”, em que será demonstrado, de maneira simples, o processo de fermentação alcoólica, que é base para a produção de diversas bebidas.
1.E- Leia o texto “Fermentação alcoólica na produção de etanol”que será disponibiliza-do pelo professor, responda às questões propostas e socialize com seus colegas.
http://qnesc.sbq.org.br/online/qnesc10/exper1.pdf
Responda as questões disparadoras abaixo, com objetivo de evocação de ideias e diagnóstico inicial:
- O que é fermentação?
- O que é necessário para que aconteça uma fermentação?
- É possível produzir etanol utilizando diferentes matérias-primas?
Roteiro de Experimentação
Materiais e reagentes
- 5 garrafas plásticas 600 mL;
- 2 colheres de açúcar (sacarose);
- Suco de maçã, suco de uva integral ou/e caldo de cana;
- 1 colher de farinha de trigo;
- 2 envelopes de fermento de pão granulado (Saccharomyces cerevisiae);
- 200mL de água morna;
- 1 béquer 250mL;
- 5 bexigas de borracha, nº3.
Procedimento
- Separe as 5 garrafas, numere-as de I a V conforme indicação: I- Água + fermento biológico;
II- Água + fermento biológico + açúcar;
III- Água + fermento biológico + farinha de trigo;
IV- Caldo de cana + fermento biológico;
V- Suco de uva integral/suco de maçã + fermento biológico;
- No béquer, dissolva o conteúdo do envelope de fermento de pão em 150 mL de água morna;
- Adicione 50 mL do líquido preparado (fermento + água) nas garrafas I, II e III;
- Tampe a garrafa I com uma bexiga, tendo o cuidado de verificar se está devidamente vedada. Deixe em repouso e observe o resultado;
- Adicione na garrafa II, 2 colheres de açúcar, misture até total dissolução. Tampe a garrafa com a bexiga. Deixe em repouso e observe o resultado;
- Adicione 1 colher de farinha de trigo na garrafa III, misture. Tampe a garrafa com a bexiga. Deixe em repouso e observe o resultado;
- Na garrafa IV, adicione 5g de fermento granulado em 50 mL de caldo de cana. Agite. Deixe em repouso e observe o resultado. Repita o mesmo procedimento com o suco de maçã/ suco de uva integral;
- Anote os resultados na tabela 1.3.
- Amostras
Houve Transformação Química? Quais as Evidências?
Conforme suas observações e resultados, complete a tabela 1.1.
I Água +fermento biológico
II Água + açúcar + fermento biológico
III Água + farinha de trigo + fermento biológico
IV Caldo de cana + fermento biológico
V Suco de uva integral + fermento biológico
Após o experimento, responda às questões e socialize com seus colegas:
a. Em quais frascos ocorreu transformação química? Qual é o nome dado a essa transformação?
b. É possível reverter as transformações químicas ocorridas (são revertíveis)?
c. Em alguma das amostras, você observou se houve diferença na quantidade de formação dos produtos? Aconteceu de forma instantânea?
d. O que acontece se colocarmos as amostras na geladeira ou congelador? E se colocarmos a 50°C? Informação: temperatura ótima de crescimento da levedura está entre 20°C e 30°C.
A produção de álcool em sala de aula pode ser feita por meio da adição de farinha de trigo ou açúcar a uma solução aquosa de fermento biológico.
Materiais e procedimentos:
* 100 g de açúcar;
* 100 g de farinha de trigo;
* 30 g de fermento biológico;
* 2 colheres de chá (1 colher de chá corresponde a 2,5 mL);
* 2 colheres de sopa (1 colher de sopa corresponde a 10 mL);
* 6 béqueres ou 6 copos de vidro;
* caneta esferográfica para identificar os copos (ou etiquetas);
* banho de gelo ou geladeira.
Procedimento Experimental:
1. Misture bem o fermento com 120 mL de água em um copo;
2. Coloque 20 mL dessa solução de fermento e água em cinco copos numerados;
3. No copo 1, adicione 2 colheres de chá de farinha de trigo e misture bem;
4. Depois de 15, 30 e 40 minutos, agite novamente a solução e anote o que você observar;
5. Faça o mesmo no copo 2, mas em vez de usar farinha, use o açúcar;
6. Agora nos copos 3 e 4, você colocará em cada um 2 colheres de chá de farinha e 2 colheres de chá de açúcar, repectivamente, misturando bem;
7. Coloque o copo 3 no banho de gelo ou no congelador;
8. Novamente, depois de 15, 30 e 40 minutos, agite as soluções nos copos 3 e 4, bem como anote o que você observar;
9. No copo de número 5, coloque apenas a solução aquosa de fermento que você preparou e também a agite depois de 15, 30 e 40 minutos.
Resultados e Discussão:
Qual o gás formada durante a reação de fermentação, e que equação química corresponde a essa reação.
O gás observado é o dióxido de carbono (CO2).
As reações que ocorrem nos copos 2, 3 e 4 são as reações enzimáticas mostradas na introdução deste texto, que são causadas pelas leveduras presentes no fermento biológico. O produto orgânico da fermentação da sacarose é o álcool ou etanol.
A reação do copo 1 é mais lenta do que as que ocorrerm nos copos 2, 3 e 4 porque nele contém a farinha com a solução aquosa de fermento, em que a cadeia carbônica do amido da farinha é rompida, transformando-se na glicose e na frutose, que depois se transformam no etanol pela ação dos micro-organismos.
Outro fator a ser observado é que, quando se coloca o copo 3 no banho de gelo, a formação de bolhas de CO2 ocorre mais lentamente, pois a diminuição da temperartura diminui a velocidade da reação.
No copo 5 não há a formação de álcool, o que nos mostra que é preciso açúcar para a ocorrência das reações.
Experimentação
Conceitos de transformação química a partir das evidências macroscópicas (formação de gás carbônico, mudanças de temperatura etc.), tempo, energia, revertibilidade e os aspectos gerais (matérias-primas envolvidas, produtos obtidos), para que os(as) estudantes tenham compreensão de todo o processo e reconheçam a importância da utilização desse processo no dia a dia e no sistema produtivo.
A atividade 1 permite também, trabalhar os processos de separação de substâncias contemplando os métodos utilizados na produção de etanol.
Tais como, observar o processo de ventilação usado para a separação da palha da cana-de-açúcar na colheita; a separação magnética ocorrida após a lavagem da cana com o objetivo de retirar os materiais ferrosos e componentes metálicos; a peneiração do caldo para retirar as impurezas; a decantação do caldo com a formação do lodo; a destilação do vinho fermentado para aumentar o teor alcoólico para 96%. Outros processos que envolvem o dia a dia do(a) estudante também poderão ser acrescentados, a fim de contextualizar o tema, como: filtração, catação, decantação, cristalização, etc.
Qual a importância da produção de etanol para a economia do Brasil, a primazia em relação aos outros países e algumas informações e dados da produção, como o rendimento e os custos envolvidos, que evidenciam essa vantagem mundial
Questões de análise do texto
a. De acordo com o experimento “Fermentação alcoólica” realizado no item 1.D e o texto “Fermentação alcoólica na produção de etanol”, destaque os reagentes e produtos envolvidos no processo.
Esse processo envolve absorção ou liberação de energia?
b. Escreva os processos de separação de misturas que ocorrem durante a produção de etanol.
c. Segundo o texto, como a indústria obtém etanol puro (100%)? Ocorre alguma transformação química? Justifique.
1.F- Elabore um fluxograma ou um mapa conceitual que represente a produção de etanol, desde a matéria-prima até o produto final (etanol 100%). Registre no espaço a seguir e socialize com seus colegas.
1.G- Para ampliar os estudos sobre a “Importância da produção de etanol no Brasil”, realize uma pesquisa evidenciando os aspectos econômicos, sociais e ambientais, conforme orienta-ções de seu professor. Na sequência, preencha a tabela 1.2, destacando os pontos relevantes em relação às vantagens e desvantagens da produção de etanol.
Aspectos Vantagens Desvantagens
Econômicos 1 g/cm3
Sociais
Ambientais
Tabela 1.2
1.H- Considere os fenômenos da tabela 1.3 e complete o que se pede:
Fenômenos Ocorre Transformação Quais as Endotérmico Revertível ou Instantânea ou
Química? Evidências? ou exotérmica? Irrevertível? não instantânea?
Aquecimento da
parafina
Derretimento de
um sorvete
Queima do
álcool
Evaporação do
álcool
Amadurecimento
de uma fruta
Queima da vela
Fermentação do
suco de manga
Tabela 1.3
1.I – Retome as suas hipóteses construídas no item 1.B e verifique e/ou reelabore suas ideias para a construção das considerações finais, registrando no seu caderno.
ATIVIDADE 2 INTERAÇÕES E TRANSFORMAÇÕES.
As transformações físicas são aquelas que ocorrem sem que se formem novas substâncias. Os seja, as substâncias continuam a ser as mesmas, poderão apenas estar mais divididas, por exemplo, ou mudarem de estado físico.
Exemplos de transformações físicas:
- Um papel que se rasga.
- Um vidro que se parte.
- A água que ferve, evaporando-se.
- Um gelado que derrete.
As transformações químicas ocorrem, quando existe a formação de novas substâncias, isto é, substâncias com propriedades diferentes das substâncias iniciais.
São exemplos de transformações químicas, muitas das situações que te rodeiam no dia-a-dia, tais como:
- Quando grelhas um bife.
- A fruta que amadurece na fruteira.
- Um fósforo que arde.
- A fotossíntese realizada pelas plantas.
- O enferrujamento do ferro.
No decurso das transformações químicas ou reações químicas em que se formam as novas substâncias, existem algumas evidências facilmente observáveis que permitem verificar a ocorrencia dessas transformações. Por exemplo:
- Uma mudança de cor.
- A libertação de um gás.
- A formação de um sólido.
- A formação de uma chama.
- O aparecimento de um cheiro característico.
- O desaparecimento das substâncias iniciais.
Numa transformação química, as substâncias iniciais chamam-se reagentes e as novas substâncias que se formam chamam-se produtos de reação.
As transformações químicas podem ocorrer por:
Em síntese, uma transformação é evidenciada pelas diferenças entre o estado inicial e o estado final. Durante uma observação é importante anotar dados que possam contribuir para o entendimento, mas, também, a estabelecer os limites em que essas conclusões são válidas.
Fatores que podem ser considerados nas interações e transformações químicas.
Tempo, energia, revertibilidade e evidencia.
Fator tempo nas transformações químicas
Verificamos em nosso dia a dia que há reações químicas mais lentas e outras mais rápidas. Às vezes nos interessa acelerar uma reação. Isso pode ser conseguido, usando-se, por exemplo.
- gesso ortopédico, cuja secagem é rápida;
- panela de pressão, que acelera o cozimento dos alimentos;
Outras vezes, nos interessa desacelerar uma reação. Para que isso pode ocorrer, pode-se, por exemplo:
- usar a geladeira e/ou freezer para retardar a decomposição dos alimentos;
- retardar a ferrugem utilizando-se produtos químicos e tintas especiais;
O fator energia nas interações e transformações químicas
Processos que liberam calor são denominados exotérmicos e nos transmitem sensação de aquecimento. É o caso, por exemplo, das combustões.
Por outro lado, a sensação de frio que sentimos ao sair de um banho, ou quando pegamos um cubo de gelo, está associada a processos endotérmicos. Tais processos – evaporação e fusão da água – absorvem calor do ambiente e isso pode ser percebido pelo nosso corpo.
Processos revertíveis e irrevertiveis
Outro fator a ser considerado nas interações e transformações químicas é a possibilidade de revertê-las. Este fator é importante, pois grande parte das transformações químicas é irreversível, ou seja, uma vez que o reagente se transforma em produto, pode ser difícil recuperá-lo. Podemos classificar os processos que são facilmente revertidos sem a adição de novos materiais como revertíveis; por exemplo, o derretimento da parafina na produção de vela e a desidratação do sulfato de cobre pentahidratado.
Podemos classificar como processos irrevertiveis aqueles que, para recuperar os reagentes, requeiram o uso de outros materiais e processos, como a corrosão de um portão de ferro e a dissolução de um comprimido efervescente de sal de fruta.
Situação de aprendizagem 5
Como reconhecer que houve uma transformação Química quando não há evidencias
Propriedades especificas da matéria TE, TF, solubilidade, densidade
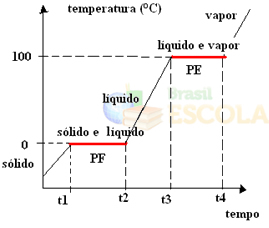
Ponto de Fusão e Ponto de Ebulição
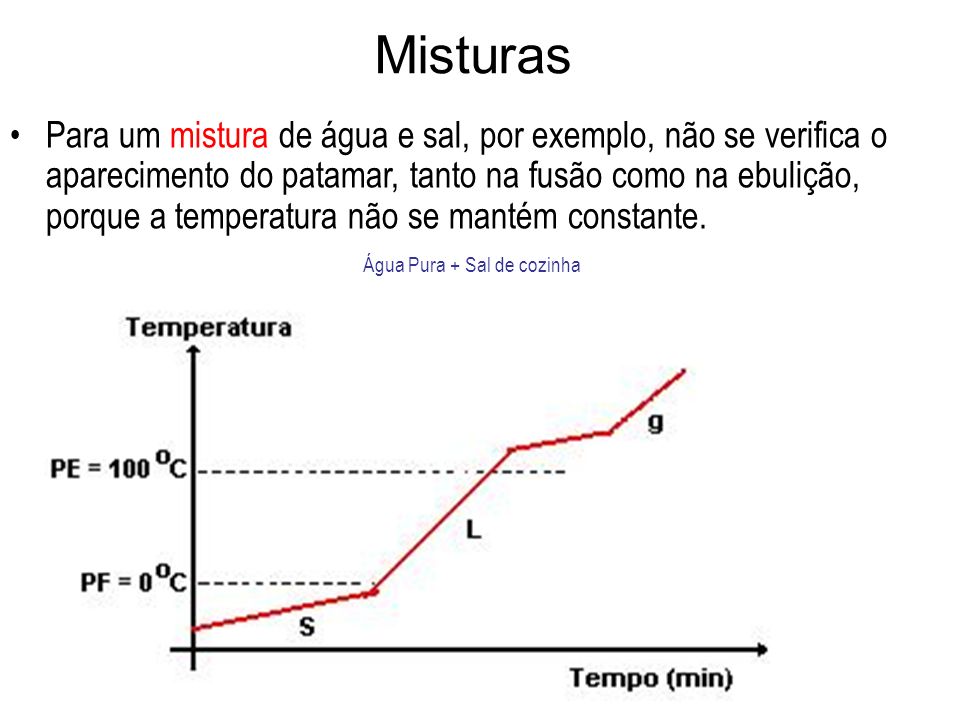
A fusão da água sólida ocorre à temperatura fixa de 0 °C ao nível do mar. Essa temperatura é o ponto de fusão (PF) da água ao nível do mar. A ebulição da água também ocorre a uma temperatura constante, que é de 100 °C ao nível do mar. Essa temperatura é o ponto de ebulição (PE) da água ao nível do mar. O ponto de ebulição das substâncias pode variar bastante, dependendo da pressão atmosférica do local em que a experiência é feita. A pressão atmosférica, por sua vez, varia sensivelmente com a altitude do local.
Esses resultados permitem afirmar que:
a) o ponto de fusão da água é 0 °C, o do etanol é – 114 °C e do naftaleno é 80 °C;
b) o ponto de ebulição da água é 100 °C, o do etanol é 78 °C e o do naftaleno é 218 °C
Ponto de fusão (PF) e ponto de ebulição (PE) de algumas substâncias, em graus Celsius °C, ao nível do mar.
OBS.: No aquecimento ou no resfriamento de determinada substância a temperatura permanece constante (no ponto de fusão ou de ebulição) enquanto a mudança de estado físico estiver ocorrendo.
DENSIDADE
Densidade de um objeto ou de uma amostra de certo material ou substância é o resultado da divisão da sua massa pelo seu volume.
A massa e o volume da cortiça são diretamente proporcionais. Quando o volume aumenta, a massa aumenta na mesma proporção. O mesmo ocorre com o chumbo. Matematicamente, podemos dizer que a razão (divisão) entre a massa e o volume de um pedaço de cortiça fornece resultado constante. O mesmo podemos afirmar para o chumbo.
A razão entre massa e volume para a cortiça é:
O resultado obtido (0,32 g/cm3) é a densidade da cortiça, grandeza que nos informa o quanto de massa existe em certo volume. No caso do nosso exemplo de 1 cm3 .
SOLUBILIDADE
O álcool e água se misturam em quaisquer proporções, mas há materiais que tem solubilidade limitada em água, como o sal de cozinha (cloreto de sódio) ou o açúcar (sacarose). Isso significa que, para um dado soluto, existe uma quantidade máxima que pode estar dissolvida em um dado volume de solvente, em uma dada temperatura. :Essa quantidade é chamada de SOLUBILIDADE, sendo comumente expressa em gramas de soluto/100 g de solvente.
Exemplos: A solubilidade do sal de cozinha a 25 °C é de 36g/100g de água. Isto quer dizer que esta temperatura é possível dissolver 36 g de sal em 100 g de água.
ATIVIDADE 2 – RECONHECENDO OS MATERIAIS POR MEIO DAS PROPRIEDADES
2.A – De acordo com o tema apresentado, discuta com seus colegas as seguintes questões:
- Como é possível obter etanol de qualidade?
- Como são feitos os testes nos postos para a verificação da qualidade do etanol?
- Como é possível diferenciar uma substância pura de uma mistura por meio da tempera-tura?
- O que significa uma substância ser solúvel? Existe um limite de solubilidade? É possível calcular esse valor?
2.B – Após a discussão, registre as suas ideias e hipóteses com relação a cada situação–problema.
2.C- Realize o experimento “Construindo um densímetro de baixo custo”.
Roteiro experimental
Materiais
• 1 prego de medida 17 x 21 mm (medida padrão);
• 1 canudinho de refresco (aproximadamente 21 cm de comprimento e 0,6 cm de diâmetro);
• Cola de secagem rápida;
• 1 copo contendo 200 mL de água;
• 1 copo contendo 200 mL de óleo de cozinha;
• 1 copo contendo 200 mL de glicerina; Figura 1 -Esquema de montagem
• 1 caneta de retroprojetor ou pedaços de fita adesiva. Procedimento
• Passe a cola na parte superior do prego de forma, que ao introduzir no canudinho de refresco, fique vedado. É importante que o canudinho tenha o diâmetro próximo da cabeça do prego, conforme demonstrado na figura 1;
• Mergulhe seu densímetro no copo contendo água e faça uma marca no canudo na al-tura do líquido usando uma caneta ou fita. Para essa altura, adote h1;
• Repita o mesmo processo para os copos contendo óleo de cozinha (h2), álcool (h3) e glicerina (h4);
• Determine a densidade das substâncias a partir da densidade da água (d1), que vale 1 g/cm3. As densidades desconhecidas (d2, d3 e d4) são obtidas nas mesmas unidades e ficam dependentes, unicamente, da relação das alturas do canudo na água (h1) e das substâncias (h2, h3 e h4). Anote os dados na tabela 2.1;
• Realize uma pesquisa sobre os valores teóricos das densidades do óleo de cozinha, glicerina e álcool. Compare com os valores encontrados na atividade experimental e registre na tabela 2.1;
• Para finalizar, discuta e socialize os resultados com os colegas.
| Substância | Altura submersa do densímetro (cm) | Densidade (g/cm3) |
| Água | 1 g/cm3 | |
| Óleo de cozinha | d2= h2 x 1 h1 | |
| Álcool (etanol) | ||
| Glicerina |
Tabela 2.1
2.D- Realize uma pesquisa sobre como é realizado o teste de qualidade do etanol na indús-tria e nos postos de combustível. Registre as principais ideias. Socialize com os colegas.
2.E- Utilize o simulador “Vamos descobrir se a sua joia é verdadeira?” http://www.
labvirtq.fe.usp.br/simulacoes/quimica/sim_qui_joias.htm para descobrir o tipo de metal usado na confecção de uma peça adquirida na joalheria. Para isso, você de-
verá calcular a densidade, com massas diferentes, de acordo com as seguintes instruções:• No simulador, selecione a opção de metal e considere 4 amostras de massas diferentes indicadas na tabela 2.2;
• Observe o volume deslocado e anote o valor;
• Calcule as respectivas densidades e registre o valor.
Amostra do metal Massa (g) Volume (mL) Densidade (g/mL)
1ª 25
2ª 50
3ª 75
4ª 100
Tabela 2.2
• O que é possível perceber entre os valores de massa e volume? Registre suas impres-sões.
• Compare o valor da densidade do objeto desconhecido com o valor da densidade dos metais apresentados na tabela 2.3 e descubra o metal em questão. Escreva o metal utilizado para a confecção da joia: ___
| Metal | Densidade (g/cm3) |
| Ouro (Au) | 19,3 |
| Prata (Ag) | 10,5 |
| Platina (Pt) | 21,4 |
| Zinco (Zn) | 7,1 |
Tabela 2.3 – Fonte dos dados: LabVirt
2.F- Com o auxílio do simulador “Mudanças de fases”, disponível em: http:// curriculomais.educacao.sp.gov.br/mudancas-de-fases-da-agua-em-funcao-da–temperatura/, complete as informações da tabela 2.4. Construa um gráfico da temperatura em função do tempo. Trace a curva de aquecimento segundo as orientações do professor. Apresente para seus colegas.
| Tempo (s) | Temperatura (°C) |
| 0 | -30 |
| 20 | 0 |
| 40 | 0 |
| 60 | 50 |
| 80 | 100 |
| 100 | 100 |
| 120 | 130 |
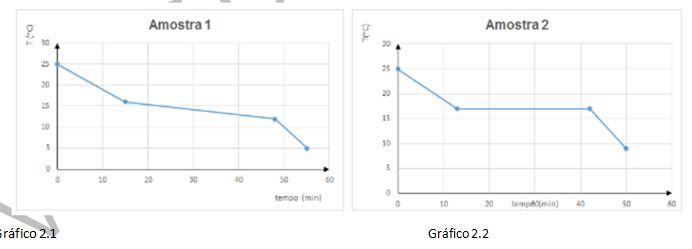
2.G- Um laboratório recebeu duas amostras de líquidos para verificar a pureza de ambos. Para tanto, cada uma das amostras foi lentamente resfriada e, a partir dos valores de temperatu-ra e tempo de resfriamento, construíram-se os gráficos 2.1 e 2.2.
34
C) Amostra 1
o 30
T (
25
20
15
10
5
0 0 10 20 30 40 50 60
tempo (min)
Gráfico 2.1
C) Amostra 2
o 30
T (
25
20
15
10
5
0 0 10 20 30 40 50 60
tempo (min)
Gráfico 2.2
Obs: Considere as amostras nas mesmas condições de pressão atmosférica.
A partir dos gráficos das amostras 1 e 2, qual delas não se encontra pura? Justifique sua resposta.
2.H- Analise o gráfico 2.3, que mostra como a temperatura de alguns sólidos varia com o aquecimento, e responda às questões. (Questão adaptada do Material de Apoio ao Currículo do Estado de São Paulo- Química- 1ª série- vol.1, 2014).

T (oC)
350 chumbo
300
250 estanho
200
150
100 enxofre
naftaleno
50
0
0 10 20 30 40 50 60 70 80 90
t (min)
Gráfico 2.3
a) Sabendo-se que à temperatura ambiente (25°C) o naftaleno, o enxofre, o estanho e o chumbo estão no estado sólido, indique o estado físico de cada substância, quando possí-vel, nos seguintes casos:
Substância Naftaleno Enxofre Estanho ChumboI À temperatura de 60°C
II Após 30 min de aquecimento
III Após 60 min de aquecimento
Tabela 2.5
b) Qual é a temperatura de fusão de cada uma dessas substâncias? Como você obteve essa informação?
c) Duas amostras de materiais de origem desconhecida foram aquecidas até a fusão, que ocorreu à temperatura de 80°C no primeiro caso e de 150°C no segundo. Essas amostras podem ser de algumas das substâncias mostradas no gráfico? Justifique.
2.I- A tabela 2.6 apresenta as temperaturas de fusão e de ebulição de algumas substâncias à pressão de 1 atm.
| Substância | Temperatura de fusão (°C) | Temperatura de ebulição (°C) |
| Água | 0,0 | 100,0 |
| Álcool etílico (etanol) | -117,3 | 78,5 |
| Acetona | -95,4 | 56 |
| Cloreto de sódio | 801 | 1413 |
| Cobre | 1083,4 | 2567 |
| Éter | -116,2 | 34,5 |
| Ferro | 1535 | 2750 |
Tabela 2.6
Faça a análise desses dados e preencha o quadro abaixo com os estados físicos das substâncias listadas nas temperaturas de 10°C, 50°C e 80°C.
Substância 10°C 50°C 80°C
Água
Álcool etílico(etanol)
Acetona
Cloreto de sódio
Cobre
Éter
Ferro
Tabela 2.7- Questão adaptada do Material de Apoio ao Currículo do Estado de São Paulo- Química- 1ª série- vol.1, 2014.
2.J- Uma amostra de substância sólida foi aquecida de 25°C a 80°C em intervalos de tempo de 5 minutos, conforme a tabela 2.8:
Tempo (min) Temperatura (°C)
0 25
5 39
10 53
15 67
20 80
25 80
30 80
Tabela 2.8
• Usando o espaço milimetrado construa um gráfico da temperatura em função do tem-po. Trace a curva de aquecimento segundo as orientações do professor.
• O que significa a temperatura permanecer constante após 20 minutos de aqueci-mento?
2.K- A solubilidade também é uma propriedade característica das substâncias, que pode ser utilizada para identificá-las. Com esse objetivo, observe a tabela 2.9:
| Temperatura (°C) | Solubilidade do sal de cozinha (g / 100 g H2O) |
| 0 | 35,7 |
| 25 | 36,0 |
| 50 | 37,0 |
| 100 | 39,8 |
Tabela 2.9 -Questão adaptada do Material de Apoio ao Currículo do Estado de São Paulo- Química- 1ª série- vol.1, 2014.
• Com os dados, construa no papel milimetrado um gráfico da solubilidade em função da temperatura.
• Observando o gráfico construído, responda:
a) O que acontece com a solubilidade do sal de cozinha quando aumentamos a tempera-tura?
b) Qual a massa de sal de cozinha capaz de se dissolver em 100 g de água a 70°C?
2.L- No laboratório de Química foram eliminados diferentes resíduos de diversos experimentos misturados em um recipiente. Dessa mistura, sabe-se da presença de areia, limalha de ferro, sal de cozinha, óleo de soja e água, conforme a figura 2.

Para reaproveitar cada uma das substâncias, proponha a sequência de 4 métodos de separação da mistura, explicando cada um deles. Indique quais propriedades aparecem na separação em cada método. Registre no caderno.
Óleo
Água + sal
Areia + limalha de ferro
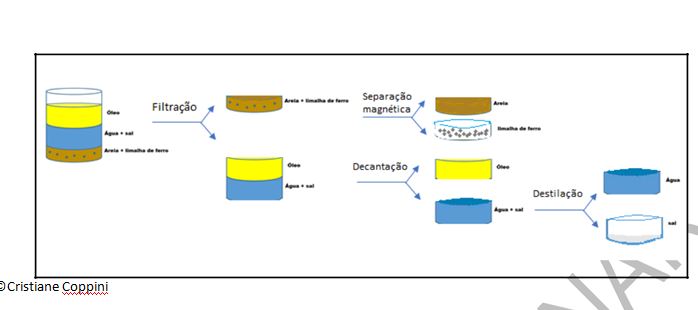
Figura 2
2.M- Retome as questões com suas hipóteses iniciais construídas na Atividade 2.B e confirme ou reelabore em seu caderno. Na sequência, socialize seus saberes com os colegas.


