Aula 1
Semana 06/08
Caro Aluno: Seja bem-vindo ao curso de Química.
Apresentação.
ACORDO PEDAGÓGICO.
Sabemos quanto é difícil para quem trabalha ou procura um emprego, cuidar da casa, da família se dedicar aos estudos, principalmente quando se parou de estudar há algum tempo.
No entanto os estudantes jovens e adultos têm experiências pessoais que devem ser consideradas no processo de aprendizagem. Trata-se de um conjunto de experiências, conhecimentos e convicções que se formou ao longo da vida. Dessa forma, procuramos respeitar a trajetória daqueles que apostaram na educação como o caminho para a conquista de um futuro melhor.
Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania.
“Amarás ao teu próximo como a ti mesmo”. Respeito Mútuo é o principal compromisso ético que todo ser humano deve assumir é o de tratar as pessoas como pessoas, procurando entender o ponto de vista do outro mesmo que não esteja de acordo com seus princípios e teorias.
O intuito é ajudar crianças e adolescentes a aprenderem a aprender, a buscarem o desenvolvimento a serem protagonistas da própria aprendizagem como ser integral e vislumbrarem suas potencialidades de ação social.
Não seja vítima da sua própria história! Não espere que alguém faça por você aquilo que só você pode fazer; escrever a sua história. Não seja manipulado por discursos políticos que promovem o coitadismo e por isso merecem uma recompensa do Estado. Nossa recompensa é o fruto que colhemos.
A colheita é consequência do que plantamos. Nada funciona de forma diferente, se você plantar e perseverar, você vai colher.
Visando manter a necessária organização em todos os momentos dentro do Curso e, em nome do clima de cooperação e amizade que deve imperar entre todos, solicitamos sua atenção para que sejam rigorosamente observadas as seguintes normas:
Procure adotar uma postura ativa e não passiva na aprendizagem, para que tenha um ótimo aproveitamento escolar. É isso que todos os professores esperam de você: seu interesse, esforço, determinação e comprometimento.
É tempo de descobrir, conhecer, questionar. Entretanto procure ser sempre cooperativo com sua equipe e amigo de seus professores; cultive o bom-humor e disposição à aprendizagem.
Essa é a base de sua formação de atitudes em direção à vida adulta, sejam quais forem seus cursos e especializações (não importa a área). Desejamos a você muito sucesso nesta jornada que se inicia!
“A educação é a arma mais poderosa para mudar o mundo, a educação liberta, quem estuda não aceito ser escravo” Nelson Mandela
Esperamos que você conclua o Ensino Médio e, posteriormente, continue estudando e buscando conhecimentos importantes para seu desenvolvimento e sua participação na sociedade. Afinal, o conhecimento é o bem mais valioso que adquirimos na vida e o único que se acumula por toda a nossa existência.
Bons estudos!
O QUE PRECISO FAZER?
Fazer as pesquisas em casa para introduzir o conteúdo, ler o texto com atenção. Assistir vídeo aulas. Na sala de aula faremos discussão e debate do tema e tiraremos as dúvidas.
ESTRATÉGIAS
As aulas são desenvolvidas a partir de um levantamento prévio do conhecimento dos alunos, solicitasse pesquisas sobre o tema para introduzir o conteúdo, utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apóia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros.
AVALIAÇÃO
• Todas as atividades desenvolvidas pelos estudantes serão avaliadas no processo de aprendizagem:
• 50% pontos (Avaliação atitudinal): responsabilidade, pontualidade, participação em aula, tarefas de casa, comprometimento, empenho em aprender, respeito e tolerância às limitações dos colegas, disciplina, cooperação, frequência, caderno, apostila, participação em projetos, pesquisas e trabalhos.
• 50% pontos (Avaliação conceitual): exercícios de fixação e prova.
RECUPERAÇÕES DA APRENDIZAGEM
O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma.
PESQUISAS PARA INTRODUÇÃO DO CONTEÚDO.
Tema 1 – A atmosfera terrestre. A atmosfera pode ser considerada uma fonte de materiais úteis para o ser humano?
Tema 2 – A rapidez das reações químicas e como ela pode ser alterada
Tema 3 – A hidrosfera e o equilíbrio iônico da água e o pH
Tema 4 ‒ Recursos da litosfera e da biosfera Recursos não renováveis: petróleo, gás natural e carvão mineral.
Tema 5 – O átomo de carbono e os compostos orgânicos
Aula 2
Semana 13/08
Situação de Aprendizagem 1 – A atmosfera pode ser considerada uma fonte de materiais úteis para o ser humano?
Conteúdos e temas: composição média do ar atmosférico; obtenção do oxigênio, do nitrogênio e dos gases nobres por destilação fracionada do ar atmosférico; diversos usos do oxigênio, do nitrogênio e dos gases nobres.
Competências e habilidades: desenvolver a leitura e a interpretação de textos, de tabelas, de esquemas e de linguagens próprios da Química; desenvolver as habilidades de síntese e de argumentação consistentes exigidas em algumas questões que acompanham os textos; compreender o processo da destilação fracionada no nível macroscópico para poder explicá-lo no nível microscópico; buscar, selecionar, organizar e relacionar dados e informações apresentados em diferentes mídias e representados em diferentes formas para resolver problemas.
Sugestão de estratégias de ensino: discussões desencadeadas por perguntas e por análises de informações; leitura de textos seguida de discussões; pesquisas em material escrito e na internet. Sugestão de recursos: material escrito; cópias de textos acompanhados de perguntas abertas; livros didáticos e paradidáticos. Sugestão de avaliação: respostas dadas às questões propostas; realização das tarefas requisitadas
Composição do ar atmosférico
– parte 1
SITUAÇÃO DE APRENDIZAGEM 1 A BIOSFERA COMO FONTE DE MATERIAIS ÚTEIS AO SER HUMANO
PSIU!!! BOM DIA…BOA TARDE…BOA NOITE…
Quando você se levantou pela manhã, eu já estava do seu lado, enquanto dormia, eu vigiava e guardava o seu sono. Eu lhe acompanhei durante o dia e você nem percebeu que eu estava do seu lado. Você trabalhou,viajou,realizou negócios, alcançou vitórias, mas…você não percebeu que eu estava cooperando com você. Não lhe culpo por não me notar, pois estou tão perto, que me tornei invisível, mas sem mim você não vive.
O ar atmosférico, o ar que nos rodeia, por ser transparente e muitas vezes inodoro, é tido como um nada, como um espaço vazio. Mesmo quando o vento sopra, quando ouvimos notícias sobre furacões, quando as previsões do tempo apresentam falas como “Uma massa de ar frio vinda do litoral deverá atingir a costa…”, não pensamos no ar como matéria, como uma mistura de gases. Em hospitais, pacientes com dificuldades respiratórias utilizam máscaras de oxigênio. Em algumas dessas máscaras, o ar atmosférico pode ser enriquecido com diferentes quantidades de gás oxigênio. A escolha da composição do ar oferecido é indicada para que haja uma oxigenação adequada às necessidades de cada paciente. O gás oxigênio é comercializado em cilindros. Nas aulas de Ciências, aprendemos que o ar atmosférico é composto principalmente pelos gases nitrogênio e oxigênio. A tabela a seguir apresenta dados sobre a composição média do ar seco, assim como as temperaturas de ebulição dos componentes do ar à pressão de 1 atmosfera.
Neste volume, o foco do estudo recairá sobre a biosfera como fonte de materiais úteis para a sobrevivência do ser humano. A biosfera compreende as partes da hidrosfera, da litosfera e da atmosfera habitadas pelos seres vivos. Desse modo, a biosfera não é simplesmente um lugar, e sim um sistema de relações entre os seres vivos e entre a matéria e a energia que os circundam e das quais são constituídos.
A COMPOSIÇÃO DA ATMOSFERA
Nossa atmosfera não é homogênea – cerca de 80% dos gases que a formam ficam na troposfera, região mais baixa, que vai do nível do mar até cerca de 15 km de altura. À medida que você se afasta da superfície da Terra, a atmosfera fica cada vez mais rarefeita, isto é, a concentração dos gases e a pressão atmosférica diminuem.
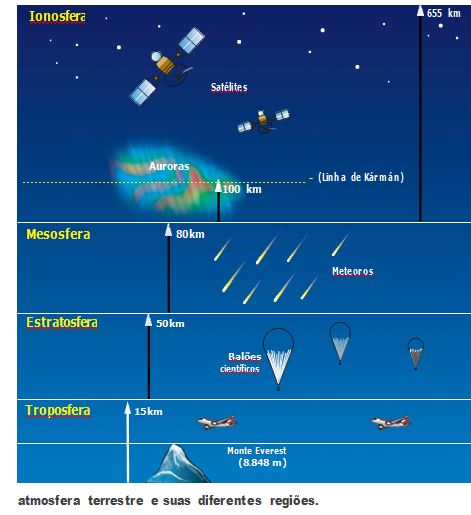
há a estratosfera, que se estende da troposfera até, aproximadamente, 50 km de altura. Ela concentra cerca de 19% dos gases existentes na atmosfera e é onde se encontra o gás ozônio, formado da interação entre a radiação ultravioleta do Sol e o gás oxigênio (O2). O gás ozônio, formado pela radiação ultravioleta, protege a Terra, sendo o responsável pela absorção da maior parte dessa radiação, que é nociva a todas as formas de vida do planeta.
A mesosfera é a região seguinte e se estende até cerca de 80 km acima da estratosfera. Nela, os corpos celestes começam a sofrer a ação do atrito, que aumenta à medida que penetram a atmosfera terrestre. Se o corpo celeste for pequeno, a ação do atrito consegue até vaporizá-lo, impedindo-o de colidir com a superfície da Terra.
Acima da mesosfera tem-se a ionosfera, que vai até cerca de 800 km da superfície da Terra. É formada por plasma, um conjunto de átomos, elétrons e íons positivos, que é considerado o quarto estado da matéria, semelhante ao material utilizado na fabricação das TVs de plasma. É uma região muito importante para as comunicações, já que lá se propagam a sondas de rádio a grandes distâncias.
A atmosfera em que você está mergulhado já foi considerada um dos quatro elementos, responsáveis por formar tudo o que existia: ar, água, terra e fogo. Hoje, sabe-se que a atmosfera é uma mistura de gases que podem ser separados e utilizados em diferentes áreas de atividades humanas, como na Medicina, na indústria e em muitas outras.
RECURSOS OBTIDOS DA ATMOSFERA
Nossa atmosfera é formada por 78% de nitrogênio, 21% de oxigênio e 1% de diversos outros gases, sendo o argônio o que tem maior participação nessa pequena fração. Do ar atmosférico obtêm-se o gás oxigênio, o gás nitrogênio e o gás nobre argônio por meio de destilação fracionada. O processo ocorre por meio das seguintes etapas:
- O ar é purificado pela filtração, que retira assim purezas sólidas. Depois, é levado a um compressor, onde é comprimido e borbulhado em uma solução de hidróxido de sódio para se retirar o CO2 existente, segundo a reação:
2 NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l)
Então, o ar é comprimido novamente, e a água nele existente, separada.
- Esse ar comprimido passa por trocadores de calor, é resfriado por expansão a – 185 °C e liquefeito, indo à coluna de fracionamento para a destilação fracionada.
- Na torre de destilação, o nitrogênio, que apresenta temperatura de ebulição mais baixa, vaporiza e sobe pela coluna, deixando o ar líquido enriquecido de oxigênio. O processo continua até a separação total.
- Os gases, assim separados, são engarrafados sob pressão no estado líquido e comercializado.
O gás oxigênio é utilizado em diferentes indústrias, no enriquecimento do ar dos fornos em siderúrgicas, na fusão e na redução metalúrgicas, na produção de papel e celulose (como branqueador), nos processos de corte e solda, na Medicina (no enriquecimento do ar de incubadoras de recém-nascidos, em tratamentos intensivos, cirurgias, respiradores de UTIs etc.).
O gás nitrogênio é usado na fabricação do gás amônia, matéria-prima fundamental para a obtenção de fertilizantes e de ácido nítrico. Por ser pouco reativo, é utilizado: em tanques que armazenam líquidos explosivos; no transporte de alimentos, para evitar a oxidação, o desenvolvimento de bolor e o aparecimento de insetos;durante a produção de circuitos integrados existentes em todos os equipamentos eletrônicos; na fabricação de borracha e plásticos, para evitar reações indesejáveis; e na conservação das células reprodutivas tanto de seres humanos quanto de outros animais.
O argônio, também obtido das instalações de fracionamento do ar, é utilizado como gás protetor nos processos de solda e na indústria de lâmpadas e de tubos luminosos. Com exceção do hélio, que é obtido do gás natural, no qual se apresenta em maior concentração, os outros gases nobres, como o argônio, o criptônio e o xenônio, também são obtidos do fracionamento do ar atmosférico para serem utilizados em lâmpadas e na produção de atmosfera inerte(que não reage).
Além de o ar atmosférico ser fonte de substâncias, ele é também fonte de energia, sendo utilizado desde o século X nos moinhos e, hoje, nos parques eólicos na obtenção de energia elétrica.
PRESSÃO
A pressão é a força aplicada por unidade de área. Suponha que você vai mar- telar dois pregos em uma madeira, um com a ponta perfeita e o outro sem ponta. Uma boa martelada enterra o primeiro prego com facilidade, mas o segundo prego, com a mesma martelada, provavelmente vai entortar e não penetrará na madeira. Se a força aplicada é a mesma, qual a razão para um prego entrar com facilidade na madeira e o outro não? Isso se explica pelo fato de, no primeiro caso, a força ter sido aplicada sobre uma área da madeira menor que a do segundo caso.
A relação entre a força aplicada e a área que foi submetida a tal força é a pressão, representada pela equação em que P é a pressão, F, a força e A, a área em que a força foi aplicada: P = F , mostrando que a pressão é diretamente proporcional à
 A
A
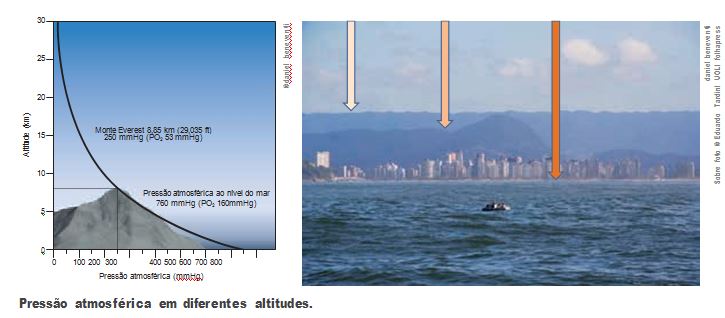
força e inversamente proporcional à áre Você já ouviu falar que a pressão atmosférica diminui com a altitude? A razão disso está na coluna de ar sobre a superfície da Terra. No nível do mar, a pressão é maior porque há uma coluna de ar maior; em uma montanha, a coluna de ar é menor, e também a pressão atmosférica. O gráfico da figura a seguir relaciona a pressão atmosférica com a altitude.
| MonteEverest8,85km(29,035ft)250 mmHg (PO2 53 mmHg) |
| Pressãoatmosféricaaoníveldomar 760 mmHg (PO2 160mmHg) |
SITUAÇÃO DE APRENDIZAGEM 2 COMPOSIÇÃO, PROCESSAMENTO E USOS DO PETRÓLEO, DO GÁS NATURAL E DO CARVÃO MINERAL
Atividade 1 – Petróleo e gás natural como fontes de materiais Você já deve ter ouvido nos meios de comunicação ou mesmo lido em revistas e jornais alguma notícia sobre a presença de petróleo na camada pré-sal das bacias do Sul e do Sudeste do Brasil. O petróleo tem importância econômica nos dias de hoje? Você já pensou que tipo de material é o petróleo? Será uma substância composta? Será uma solução? Será uma mistura? Nesta atividade, você buscará respostas para essas questões.
Leitura e análise de texto Processos envolvidos na obtenção dos derivados do petróleo
O gás natural e sua purificação O gás natural é um combustível fóssil e, assim como o petróleo, foi formado pela decomposição de matéria orgânica durante milhões de anos. Ele é encontrado em rochas porosas no subsolo e, em geral, em uma camada acima da reserva de petróleo. No entanto, as rochas porosas que armazenam o gás também podem estar em locais onde não se encontra reserva de petróleo.
Aula 3
Semana 20/08
Situação de Aprendizagem 2
Estudo da síntese e da produção industrial da amônia a partir dos gases nitrogênio e hidrogênio
Conteúdos e temas: síntese da amônia pelo processo Haber; influência da pressão e da temperatura no
controle da rapidez e do rendimento de transformações químicas; transformações químicas reversíveis
que não se completam e entram em equilíbrio dinâmico.
Competências e habilidades: compreender como os contextos histórico, econômico e cultural se inter-
-relacionam e influenciam o desenvolvimento de um novo processo químico, no caso, o da síntese da
amônia; analisar dados para compreender que existem transformações químicas que “não se completam”
segundo as previsões estequiométricas; entender o que acontece em sistemas e processos químicos
a partir de dados apresentados em tabelas e em descrições de procedimentos experimentais (experimentos
teóricos); valorizar o controle de variáveis em um processo de investigação.
Sugestão de estratégias de ensino: discussões desencadeadas por perguntas e por análises de informações;
leituras de textos seguidas de discussões.
Sugestão de recursos: material escrito, textos acompanhados de perguntas abertas.
Sugestão de avaliação: respostas dadas às questões propostas; realização das tarefas.
Aula 4
Semana 27/08
Tema 2 – Cinética Química
Teoria das Colisões

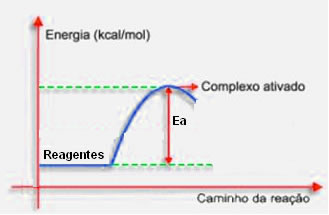
A Teoria das Colisões diz que para que uma reação ocorra, a colisão entre as partículas das substâncias reagentes deve acontecer através de uma orientação adequada e com uma energia maior que a energia mínima necessária para a ocorrência da reação.Essa energia mínima que deve ser fornecida aos reagentes é denominada Energia de Ativação (Ea). Sem atingi-la, a reação não ocorre.Quando colocamos duas substâncias em contato, suas partículas começam a colidir umas com as outras. Nem todas as colisões são eficazes, isto é, nem todas dão origem a novos produtos. No entanto, as colisões que rompem as ligações formadas e formam novas ligações, são denominadas colisões eficazes ou efetivas.
Essas colisões ocorrem de forma adequada: seu choque é frontal geometricamente e bem orientado. Observe abaixo como isso ocorre: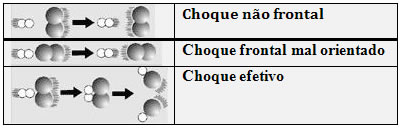
No choque efetivo as moléculas absorvem a quantidade de energia mínima necessária (energia de ativação) para a formação do complexo ativado, ou seja, um estado intermediário (estado de transição) entre os reagentes e os produtos. Nessa estrutura, as ligações dos reagentes estão enfraquecidas e as dos produtos estão sendo formadas.Observe uma reação genérica que mostra essa formação do complexo ativado abaixo:AB + XY → AX + YB
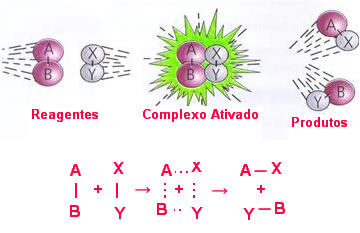
Note que quando ocorre o choque efetivo, forma-se momentaneamente o complexo ativado, no qual as ligações entre os átomos AB e XY estão se rompendo e as ligações que unirão os átomos nas moléculas AX e YB estão se formando.Observe no diagrama que se não for atingida a energia de ativação, não é possível formar o complexo ativado, pois ela serve como uma barreira energética a ser ultrapassada para que a reação química ocorra.
Para reações exotérmicas (reações que liberam energia – ?H < 0) e endotérmicas (reações que absorvem energia – ?
H > 0), temos os diagramas: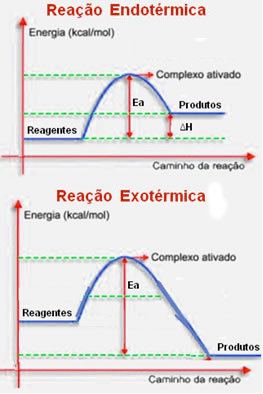 Assim, a teoria das colisões explica satisfatoriamente a rapidez com que ocorrem as reações, pois:
Assim, a teoria das colisões explica satisfatoriamente a rapidez com que ocorrem as reações, pois:
– Fatores que alteram a velocidade das reações
Existem quatro principais fatores que alteram a velocidade das reações, veja quais são:Os principais fatores que alteram a velocidade das reações são a superfície de contato, a temperatura, a concentração dos reagentes e o uso de catalisadores.


Reação entre antiácido efervescente e água em duas situações diferentes: no primeiro copo, o antiácido está em pó; no segundo, está em comprimido.
2- Temperatura: Quanto maior a temperatura, maior será a velocidade da reação.Isso acontece porque, com o aumento da temperatura, a energia cinética das moléculas das substâncias reagentes aumenta, ou seja, elas movimentam-se em uma maior velocidade, o que aumenta a quantidade de choques efetivos que resultam em uma reação mais rápida. Além disso, como a energia das moléculas aumenta, isso propicia que elas tenham a energia suficiente para reagir, que é chamada de energia de ativação.Por exemplo, quando ocorre um incêndio em uma floresta, que é um meio onde a perda de calor é pequena, a reação libera calor para o meio. Com isso, a temperatura do ambiente aumenta e isso faz com que a reação de combustão ocorra ainda mais rapidamente.

O aumento da temperatura aumenta ainda mais a velocidade dos incêndios florestais.
A panela de pressão também é usada com essa finalidade, pois o aumento da pressão aumenta a temperatura que o líquido entra em ebulição e, consequentemente, mais rápido é o cozimento do alimento. A panela de pressão é um exemplo da influência da temperatura sobre a velocidade da reaçãoPor outro lado, se queremos que uma reação ocorra mais lentamente, podemos diminuir a temperatura. É o caso de colocarmos, por exemplo, carnes no freezer, pois a baixa temperatura faz com que esse alimento decomponha-se mais devagar.
A panela de pressão é um exemplo da influência da temperatura sobre a velocidade da reaçãoPor outro lado, se queremos que uma reação ocorra mais lentamente, podemos diminuir a temperatura. É o caso de colocarmos, por exemplo, carnes no freezer, pois a baixa temperatura faz com que esse alimento decomponha-se mais devagar.
3- Concentração: Quanto maior a concentração dos reagentes, maior é a velocidade da reação. Quando aumentamos a concentração dos reagentes, aumentamos o número de moléculas ou partículas reagentes por unidade de volume e, consequentemente, o número de colisões entre elas aumenta, resultando em uma maior velocidade da reação.Um exemplo é a combustão do carvão. Se colocarmos um pedaço de carvão em brasa dentro de um frasco com oxigênio puro, a reação ocorrerá com uma velocidade muito maior. Isso porque a concentração de um dos reagentes da combustão (o oxigênio) aumentou. Antes, o oxigênio era o presente no ar, que está em uma proporção de cerca de 20%. Dentro do frasco, porém, essa proporção vai para 100%.
4- Catalisadores: São substâncias que aumentam a velocidade de determinadas reações sem participar delas, ou seja, sem serem consumidas durante a reação. Por exemplo, a água oxigenada decompõe-se com o tempo, mas quando ela é colocada em contato com o sangue de um machucado, essa reação ocorre com uma velocidade muito maior, o que é visto por meio da formação de bolhas.Isso acontece porque o sangue possui uma enzima denominada catalase que funciona como catalisadora da reação de decomposição da água oxigenada, ou seja, aumenta sua velocidade.Os catalisadores conseguem aumentar a velocidade das reações porque eles atuam mudando o mecanismo da reação por diminuir a energia de ativação da reação. Assim, com uma quantidade de energia de ativação menor, fica mais fácil para as partículas reagentes atingirem essa energia e reagirem.Entenda melhor como isso ocorre lendo o texto Como atuam as substâncias catalisadoras.
Existem outros fatores que podem interferir em reações específicas. Alguns exemplos são: luz,eletricidade, pressão (no caso de sistemas gasosos) e natureza dos reagentes (quanto maior o número de ligações dos reagentes que precisam ser rompidas e quanto mais fortes elas forem, mais demorada será a reação).
Aula 5
Semana 03/09
Tema 3 – A hidrosfera e o equilíbrio iônico da água e o pH
Em uma solução aquosa, a água sofre uma autoionização formando sempre dois íons (H3O+ e OH–).
2 H2O ↔ H3O+ e OH–
Segundo a teoria de Arrhenius, os ácidos são compostos que reagem com água e sofrem ionização, originando como único cátion o hidrônio (H3O+(aq)).
Já as bases são compostos que, em meio aquoso, sofrem dissociação iônica, liberando como único ânion a hidroxila (OH–(aq)).
Assim, para ser ácida, uma solução deve ter uma concentração maior de cátions H3O+do que de OH– livres em seu meio, e o contrário ocorre com as soluções básicas.
Ácidas: [H3O+] > [OH–]
Básicas: [H3O+] < [OH–]
No caso da água, a quantidade desses íons no meio é igual ([H3O+] = [OH–]), por isso, ela é neutra.Isso nos ajuda a entender melhor a escala de pH, que costuma ser usada entre os valores de 0 a 14, em temperatura de 25ºC.
A temperatura precisa ser especificada porque ela altera a quantidade de íons no meio. Se aumentarmos a temperatura, por exemplo, a energia das partículas também aumentará. Por isso, elas se movimentarão mais rápido, o que resultará em um maior número de choques entre elas e, portanto, em uma maior quantidade de íons produzidos.
Mas existem várias substâncias diferentes no cotidiano, além de soluções químicas usadas em laboratórios e indústrias que apresentam diferentes níveis de acidez e basicidade. Só para citar um exemplo, o café é ácido, mas quase todos sabem que o ácido sulfúrico é um ácido bem mais forte que o café.
Assim, para medir o grau de acidez e de basicidade das soluções, foram criadas as escalas de pH e pOH, respectivamente.
A sigla pH significa potencial (ou potência) hidrogeniônico e indica o teor de íons hidrônio (H3O+(aq)) livres por unidade de volume da solução. Quanto mais hidrônios houver no meio, mais ácida será a solução. Por consequência, podemos dizer que quanto mais íons OH–(aq) houver no meio, mais básica ou alcalina será a solução.
Entendendo a Escala de pH Importância do controle da acidez de soluções (pH)Saúde humana:
O pH do sangue humano precisa estar em seu limite ideal de 7,4 para absorver os minerais necessários à saúde daquele indivíduo. Qualquer alimento sólido, ou líquido, que prejudique o equilíbrio do pH ideal estará comprometendo a saúde.
Assim, o pH do sangue humano está inteiramente relacionado à saúde. Uma pequena variação do pH dá oportunidade a uma redução do seu sistema imunológico, dando oportunidade para que seres vivos prejudiciais à nossa saúde, como vírus, bactérias, fungos, que vivem em meios ácidos, com pH abaixo de 7,0 proliferem e encontrem ambiente propício para sobreviver.
A maior parte das pessoas acometidas de câncer apresentam um pH no tecido de 4,5. Em resumo, estando o pH do nosso sangue abaixo da normalidade 7,4 estamos propensos a todos os tipos de doenças: Câncer, artrite, diabetes, doenças do coração, fadiga crônica, alergias, além de doenças causadas por vírus, bactérias e fungos.Uma maneira de manter o seu pH é evitar alimentos com pH baixo, como café (em torno de 4,0), refrigerante (em torno de 2,0), cerveja (varia de 2,5 a 4,2 dependendo da marca).Açúcar é um grande rebaixador de pH. Uma água mineral de boa qualidade pode suprir todas essas carências, no entanto precisa ter as seguintes qualidades: ter pH entre 7,0 e 7,5, e ser rica em minerais.
Solo
O solo vem sofrendo várias agressões e por isso fica desequilibrado, doente. Um desequilíbrio frequentemente encontrado é a acidez do solo, responsável por grandes prejuízos para o agricultor e em consequência, ao homem que está no final da cadeia alimentar.A acidez do solo, ou o pH baixo do solo faz com que a planta deixe de absorver determinados minerais e por isso, aparecem doenças nas plantas.
Numa piscina o controle de pH inibe o aparecimento de micro-organismos que podem causar micoses e outras doenças.Num laboratório o controle de pH é usado para controle de titulações e outras dosagens.
Medir ou alterar um pH é uma tarefa elementar para indústrias, na indústria de alimentos é usado para que os produtos tenham maior durabilidade.Numa estação de tratamento de água, há controle de pH para que a água servida à população esteja dentro dos padrões desejados.
Conceito de pH e pOH
Para medir os níveis de acidez e alcalinidade das soluções, utilizam-se as escalas de pH e pOH, que medem os teores dos íons H+ e OH- livres por unidade de volume da solução.

Medição de pH de solução em laboratório com o uso de uma tira de indicador universal
Veja a escala de pH a seguir e algumas soluções do cotidiano com o seu pH aproximado:
.jpg) Escala de pH com exemplos de soluções com pH próximo ao indicado.
Escala de pH com exemplos de soluções com pH próximo ao indicado.
Quanto menor o valor do pH, mais ácida é a solução, pois a escala de pH é definida como o logaritmo negativo da concentração de íons H3O+, ou H+, na base 10. Veja como ele pode ser determinado a seguir:
colog [H+] = – log [H+]
pH = – log [H+]
[H+] = 10-pH, em mol/L
Se temos uma solução de concentração igual a 0,01 mol . L1-, por exemplo, isso quer dizer que seu pH é igual a 2. Veja:0,01 mol . L1-= 10-2 mol . L1-
10-2 mol de H3O1+ ———- 1000 mL
pH = – log [H3O1+]
pH = – log [10-2]
pH = – (-2)
pH = 2
Os cálculos acima também nos levam à conclusão de que, a cada unidade de pH diminuída, a solução fica com 10 vezes menos íons H3O+. Se temos uma solução com pH igual a 2 e outra com pH igual a 3, por exemplo, a primeira possui dez vezes mais íons hidrônio do que a segunda.
Agora vamos falar sobre o pOH ou potencial hidroxiliônico.
Essa escala refere-se à concentração dos íons OH– na solução. Analogamente ao cálculo que mostramos para o pH, temos para o pOH:
pOH = – log [OH–]
[OH–] = 10-pOH, em mol/L
Voltando à autoionização da água, temos que a água destilada (totalmente pura) possui pH igual a 7, por isso, é neutra. Dessa forma, o seu pOH também é igual a 7, pois, conforme dito, a concentração desses dois íons na água é igual. À temperatura ambiente de 25ºC, o Kw (produto iônico da água) é igual a 1,0 . 10-14 (mol/L)2. Sendo assim, chegamos à seguinte conclusão para a água:
Kw = [H+] . [OH–] = 1,0 . 10-14 mol/L
[H+] = [OH–] = 1,0 . 10-7 mol/LpH = – log [H+] pOH = – log [OH–]
pH = – log 1,0 . 10-7 pOH = – log 1,0 . 10-7
pH = 7 pOH = 7
Visto que, como mostrado acima, [H+] . [OH–] = 1,0 . 10-14 mol/L, então,em todos os casos, sejam as soluções ácidas, básicas ou neutras, a soma do pH com o pOH sempre resulta em um total de 14.
Veja como isso é verdadeiro quando aplicamos o fator (-log) nos dois lados da equação:
– log ([H+] . [OH–]) = – log 1,0 . 10-14
– log [H+] – log[OH–] = 14
pH + pOH = 14
Se temos uma solução ácida, por exemplo, com pH igual a 4, sabemos que o seu pOH é igual a 10. Os valores de 0 a 14 da escala de pH podem ser medidos precisamente por meio de um equipamento chamado pHmetro (também chamado de peagômetro)
 PHmetro usado em laboratório para medir o pH de uma solução básica.
PHmetro usado em laboratório para medir o pH de uma solução básica.
Porém, em muitos casos, são utilizados também indicadores ácido-base, ou seja, substâncias que mudam de cor de acordo com o pH da solução. Um indicador ácido-base sintético, por exemplo, é a fenolftaleína, que apresenta cor rosa quando está em contato com um meio básico, mas fica incolor se o meio é ácido.Outros dois indicadores são o papel de tornassol, que fica vermelho na presença de ácidos e azul na presença de bases, e o indicador universal, que apresenta cores diferentes para cada valor de pH.
.jpg)
Exemplos de indicadores ácido-base sintéticosPara saber mais sobre esses e outros indicadores,leia o texto Indicadores ácido-base.http://mundoeducacao.bol.uol.com.br/quimica/equilibrio-quimico-.htmhttp://manualdaquimica.uol.com.br/quimica-inorganica/teorias-acido-base-arrhenius-br%C3%B8nsted-lowry-lewis.htm
EXERCÍCIOS
- A chuva apresenta normalmente pH=5,6. Isso indica que ela é ligeiramente ácida, o que é explicado pela presença de ácido carbônico, resultante da reação entre o dióxido de carbono do ar e da água. Em grandes centros urbanos, contudo, a presença de poluentes promove o aparecimento de ácidos fortes na chuva, como o sulfúrico e o nítrico, originando o fenômeno da chuva ácida. Um técnico analisou duas amostras de chuva ácida.A amostra A apresentou pH=3,6 e a amostra B, pH=2,6.
- a) Qual das amostras é mais ácida?
- b) Quantas vezes a [H+] da amostra A é maior que na chuva “normal”?
02 . A análise de uma determinada marca de água mineral gaseificada revelou que apresenta pH=4.
Qual o valor da concentração hidrogeniônica, [H+], e da concentração hidroxiliônica, [OH-], nesse produto?
03 . Os efluentes de uma certa indústria apresentavam pH=3,7, sendo muito ácidos para serem despejados no rio. Após tratamento adequado, esses efluentes passaram a pH=6,7. O tratamento provocou que alteração numérica em [H+]?.04 . Considere amostras dos seguintes materiais:
- Água totalmente pura.
- Solução de ácido de bateria de automóvel.
- Leite de magnésia.
Coloque esses materiais em ordem crescente de:a) Acidez.b) Alcalinidade (basicidade).c) pH.d) pOH.05 . Qual meio é mais alcalino (básico): um detergente de pH=9,5 ou um limpador com amoníaco de pH=12?
Estudo do Carbono
Química Orgânica
 A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicas
A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicasA Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório.Entretanto, provou-se que o homem conseguia sim sintetizar compostos orgânicos em laboratório, e então a definição de Química Orgânica mudou para:“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.Visto que o carbono é tetravalente, podendo realizar quatro ligações de diferentes maneiras, com átomos de outros elementos ou com átomos do próprio carbono, existem milhões de seus compostos. Uma quantidade muito superior do que a de compostos inorgânicos conhecidos atualmente.Tais compostos são agrupados em diferentes funções que apresentam propriedades químicas semelhantes, tais como os hidrocarbonetos, os álcoois, as cetonas, os aldeídos, os ácidos carboxílicos, os ésteres, os éteres, as aminas, as amidas, entre outros.Veja nesta subseção como identificar cada uma dessas funções, onde elas estão presentes em nossa sociedade, a realizar a nomenclatura dos compostos orgânicos segundo as regras estabelecidas pela IUPAC, como ocorre o fenômeno da isomeria em muitas dessas substâncias e o que são os polímeros naturais e artificiais que formam os plásticos tão comuns em nosso cotidiano.
Classificação do Carbono
A classificação do carbono é baseada na quantidade dos demais átomos de carbono ligado a ele e também no tipo de ligação.
Carbono secundário: ligado diretamente a 2 outros carbonosCarbono terciário: ligado diretamente a 3 outros carbonos;
Carbono quaternário: ligado diretamente a 4 outros carbonos.
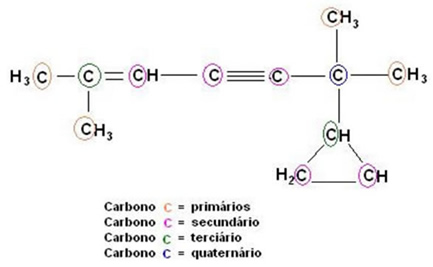 A outra classificação se refere aos tipos de ligação que unem os carbonos.O carbono pode ser classificado em função das ligações que apresenta:a) Carbono Saturado: apresenta somente ligações simples, chamadas de sigma (σ).
A outra classificação se refere aos tipos de ligação que unem os carbonos.O carbono pode ser classificado em função das ligações que apresenta:a) Carbono Saturado: apresenta somente ligações simples, chamadas de sigma (σ). b) Carbono Insaturado: presença de duplas ligações, denominadas de pi (π). Ou ainda, carbono que apresenta ligação tripla.
b) Carbono Insaturado: presença de duplas ligações, denominadas de pi (π). Ou ainda, carbono que apresenta ligação tripla.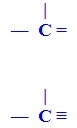
Definição atual: é o ramo da química que estuda os compostos do carbono.
Composição: o C é o principal elemento, incluem também o H, N, O, S, P e ainda os halogênios.
Características: em geral os compostos orgânicos são covalentes apolares. A presença de um elemento diferente do C e H promove certa polaridade na molécula.
H H
Ex.: H – C – H H – C – OH
H H
Apolar Polar
CARACTERÍSTICAS GERAIS
Ponto de fusão e ebulição: inferiores aos compostos inorgânicos, a maioria apresenta instabilidade térmica.
Isomeria: compostos com a mesma fórmula molecular.
Solubilidade: os apolares pouco solúveis em água, os polares solúveis, a exemplo do álcool e açúcar.
Combustibilidade: em geral são combustíveis.
Encadeamento: em função da tetravalência do C tendem a formar estruturas denominadas cadeias carbônicas.
Velocidade de reação: pouco reativos, dependem de ativadores (luz, calor, pressão, catalisadores, etc.).
Postulados de Couper – Kekulé
Através de seus estudos sobre a Química Orgânica, o químico alemão Friedrich A. Kekulé observou que o átomo de carbono apresenta algumas características muito particulares, que o distingue dos demais elementos. Para explicar o comportamento e as propriedades do carbono, Kekulé formulou 3 princípios que ficaram conhecidos como Postulados de Kekulé.
Tais postulados foram propostos no século XIX e são resultantes do trabalho de diversos cientistas, em especial, do químico Archibald Scott Couper e, claro, do próprio Kekulé. Assim, é comum também denomina-los Postulados de Couper-Kekulé.
Primeiro Postulado: O carbono é tetravalente
O elemento carbono pertence à família 4A da tabela periódica, portanto, apresenta 4 elétrons na última camada eletrônica. Para formar o octeto e, assim, adquirir a estabilidade eletrônica, o átomo de carbono compartilha seus 4 elétrons com mais 4 elétrons de outros átomos. Dessa forma, dizemos que o carbono é tetravalente, isto é, pode formar 4 ligações com outros átomos, sejam de carbono ou de outros elementos.
1º Postulado:
O carbono é tetravalente
C ( Z=6) K = 2, L = 4
Segundo Postulado: As quatro valências do carbono são iguais entre si
Numa mesma molécula orgânica, o átomo que faz ligação com o carbono pode ocupar qualquer uma das 4 posições. Observe o exemplo:
Embora o átomo de C? esteja em posições diferentes na cadeia, as quatro estruturas acima representam o mesmo composto orgânico: o clorometano (CH3 C?)
2º Postulado
As 4 valências do átomo de carbono são iguais entre sí
H H H Cl
½ ½ ½ ½
Cl – C – H H – C – H H – C – Cl H – C – H
½ ½ ½ ½
H Cl H H
Terceiro Postulado: O carbono forma cadeias
O átomo de carbono é capaz de se unir com outros átomos e formar estruturas de diversos tamanhos e disposições, que recebem o nome de cadeias carbônicas. Essas cadeias são responsáveis pelo formato das moléculas dos compostos orgânicos.
3º Postulado
Os átomos de Carbono ligam-se entre sí formando cadeias
C – C – C – C – C – C – C
O carbono não é o único elemento químico que pode formar encadeamentos: alguns outros elementos como o enxofre e o nitrogênio, por exemplo, também apresentam essa característica. No entanto, somente o carbono pode constituir cadeias tão diversificadas, extensas e quimicamente estáveis.
A tetravalência do carbono, sua capacidade de se ligar com vários tipos de elementos químicos e de formar cadeias carbônicas são as propriedades responsáveis pelo enorme número de compostos orgânicos já conhecidos. Por isso, a Química Orgânica é definida como a área da Química que trata dos compostos de carbono com características específicas.
Referências bibliográficas
FELTRE, Ricardo. Química volume 3. São Paulo: Moderna, 2005.
USBERCO, João, SALVADOR, Edgard. Química volume único. São Paulo: Saraiva, 2002.
Aula 3
CLASSIFICAÇÃO – CADEIAS CARBÔNICAS
O átomo de carbono tem a propriedade de formar cadeias carbônicas. Elas são classificadas em Aberta ou Acíclicas ou Alifáticas, fechadas ou Cíclicas ou mistas. Podem ter qualquer número de átomos de carbono na cadeia.
As cadeias aberta, apresentam duas extremidades ou pontas de cadeia.
Classificam-se de acordo com a presença de um heteroátomo ou não entre carbonos.
– homogênea – não possui heteroátomos entre carbonos.
– heterogênea – possui heteroátomo entre carbonos.
As cadeias abertas também podem ser classificadas de acordo com a presença de radicais (ramificações) na cadeia carbônica.
– normal – não possui radicais.
– ramificada – possui radicais.
As cadeias carbônicas abertas podem ser classificadas de acordo com o tipo de ligação química.
saturada – quando há na cadeia carbônica apenas ligações simples.
insaturada – quando há nas cadeias carbônicas ligações duplas ou triplas.
Cadeias fechadas
As cadeias fechadas são também chamadas de cadeias cíclicas.
São aquelas em que os átomos de carbono se ligam formando um anel (ou um círculo fechado).
Podem ser classificadas quanto à presença de um anel aromático ou não.
– alicíclica ou não aromática – são cadeias fechadas que não possuem o anel bezênico.
– aromática – são cadeias fechadas que possuem o anel aromático ou anel benzênico. Possuem ressonância entre seus elétrons. Estas cadeias, em geral, têm seis átomos de carbono que alternam ligações duplas e ligações simples.
As cadeias aromáticas podem ser classificadas de acordo com o número de anéis aromáticos:
– mononuclear: quando possui apenas um núcleo (anel aromático)
– polinuclear: quando possui vários anéis aromáticos.
Os aromáticos polinucleares podem ser classificados em:
– polinucleares isolados: quando os anéis não possuem átomo de carbono em comum.
– polinuclear condensado: quando os anéis possuem átomos de carbono em comum.
– saturada: cadeia que possui apenas ligações simples entre os átomos.
– insaturada: cadeia que possui uma dupla ligação entre carbonos.
Podem ser classificadas de acordo com a presença ou não de um heteroátomo:
– homogênea ou homocíclicas: possuem somente átomos de carbonos ligados entre si.
– heterogênea ou heterocíclica: possuem um heteroátomo entre átomos de carbono.
Cadeias mistas
As cadeias carbônicas mistas são abertas e também fechadas.
Resumo das cadeias carbônicas
Neste tópico, apresentamos um esquema para resumir o que aprendemos sobre as classificações das cadeias carbônicas abertas, fechadas e mistas.
Acompanhe a seguir o resumo e logo após um exemplo de classificação.
Exemplo: o linalol é uma substância isolada do óleo de alfazema e possui a seguinte fórmula estrutural:

Como poderia ser classificada esta estrutura?
– acíclica
– ramificada
– insaturada
– homogênea
Aula 4
Visto que o carbono é tetravalente, isto é, tem a capacidade de realizar quatro ligações covalentes com outros átomos de carbono ou com átomos de outros elementos, existe uma infinidade de compostos formados pelo carbono. Por isso, surgiu a Química Orgânica, um ramo da química que estuda as substâncias que têm como principal constituinte o carbono.No estudo da Química Orgânica é primordial saber o que é uma cadeia carbônica e compreender as diferentes formas de representá-la.Uma cadeia carbônica é uma estrutura formada quando os átomos de carbono se unem. Essas ligações podem ser estabelecidas de quatro formas, conforme mostrado a seguir: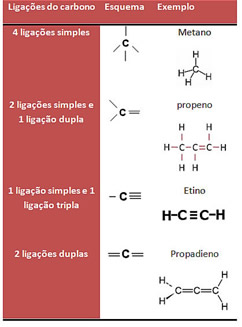
Lembre-se que cada traço corresponde a dois elétrons que estão sendo compartilhados entre os dois átomos da ligação.Uma cadeia carbônica pode apresentar grande quantidade de átomos de carbono, mas também pode conter heteroátomos, isto é, átomos de outros elementos entre os carbonos, principalmente os átomos de oxigênio, nitrogênio, enxofre e fósforo. Esses elementos podem vir também nas extremidades da cadeia, ligando-se a um átomo de carbono. Veja alguns exemplos abaixo: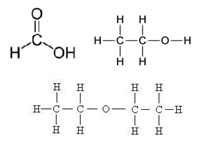 Até agora as cadeias carbônicas foram representadas através de formas chamadas de fórmulas estruturais planas. Esse tipo de fórmula mostra todas as ligações, simbolizadas pelos traços, envolvidas nas cadeias carbônicas. Porém, visto que muitas dessas cadeias podem ser longas e complexas, é comum simplificar a fórmula estrutural, condensando algumas ligações. É possível fazer isso através de dois modos. Veja cada um deles:
Até agora as cadeias carbônicas foram representadas através de formas chamadas de fórmulas estruturais planas. Esse tipo de fórmula mostra todas as ligações, simbolizadas pelos traços, envolvidas nas cadeias carbônicas. Porém, visto que muitas dessas cadeias podem ser longas e complexas, é comum simplificar a fórmula estrutural, condensando algumas ligações. É possível fazer isso através de dois modos. Veja cada um deles:
- Fórmula estrutural condensada: a primeira forma de simplificar uma cadeia carbônica é utilizar índices, isto é, números que indicam a quantidade de átomos de hidrogênio que se ligam ao carbono. Exemplo:
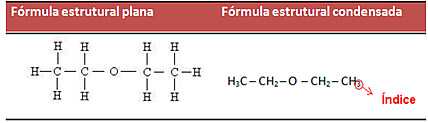 Isso também pode ser feito de forma ainda mais simplificada, utilizando índices para mostrar a quantidade de carbonos na cadeia. Veja como a fórmula mostrada anteriormente fica:H2C5 ̶ O ̶ C5H2
Isso também pode ser feito de forma ainda mais simplificada, utilizando índices para mostrar a quantidade de carbonos na cadeia. Veja como a fórmula mostrada anteriormente fica:H2C5 ̶ O ̶ C5H2
- Fórmula de traços: essa fórmula representa as ligações entre carbonos, usando traços. As pontas, bem como as pontas das inflexões, correspondem a átomos de carbono.
Exemplos: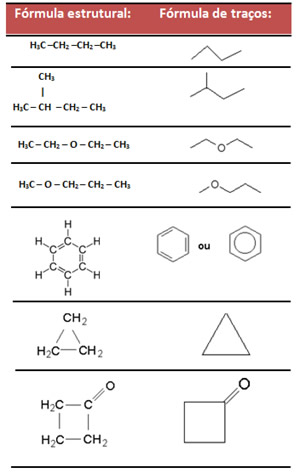 Aproveite para conferir nossas videoaulas relacionadas ao assunto:
Aproveite para conferir nossas videoaulas relacionadas ao assunto:
REPRESENTAÇÃO DAS CADEIAS CARBONICAS
Os átomos de carbono têm como característica principal a propriedade de se unirem formando estruturas denominadas cadeias carbônicas. É essa capacidade de se encadear que possibilita a existência de milhões de compostos orgânicos diferentes.
Além de átomos de carbono, as cadeias podem apresentar átomos de outros elementos, desde que eles se localizem entre os átomos de carbono. Os elementos mais frequentes no encadeamento são O, N, S, P, que são denominados heteroátomos.
Átomos como o hidrogênio e halogênios também podem fazer parte de compostos orgânicos, mas como esses átomos são monovalentes, eles nunca farão parte da cadeia carbônica, apenas da molécula.
Para representar as cadeias carbônicas de maneira mais simples, é comum utilizar a notação em bastão, que indica cada ligação entre carbonos por traços (—) e cada carbono se transforma em um ponto de inflexão ou nas extremidades dos traços.
Cadeia carbônica é o conjunto de todos os átomos de carbono e de todos os heteroátomos que constituem a molécula de qualquer composto orgânico.
Outra maneira de simplificar a representação podemos indicar, por meio de índices, a quantidade de átomos de hidrogênio e carbono presente na estrutura:
Classificação das cadeias carbônicas
As cadeias carbônicas podem ser classificadas de diversas maneiras:
Quanto à disposição dos átomos de carbono
Cadeia aberta, alifática ou acíclica: é composta pelo menos de duas extremidades e não apresenta ciclos na cadeia.
Cadeia fechada ou cíclica: não apresenta extremidades e os átomos fecham em pelo menos um ciclo.
As cadeias fechadas ou cíclicas ainda se dividem em dois grupos: aromáticas e não aromáticas.
Cadeias aromáticas: possuem pelo menos um anel aromático, que é um anel que contém ligações duplas alternadas. Podem ser ramificadas ou não.
As cadeias aromáticas, podem ainda, ser divididas entre mononucleares (um núcleo) ou polinucleares (mais de um núcleo). As polinucleares podem ser isoladas (núcleos não compartilham átomos) ou condensadas (núcleos compartilham átomos).
Cadeias não aromáticas ou alicíclicas: possuem uma cadeia fechada, porém que não tem as ligações duplas alternadas.
Cadeia normal ou linear: apresenta somente duas extremidades, sem ramificações.
Cadeia ramificada: apresenta no mínimo três extremidades, pois possuem ramificações.
Quanto ao tipo de ligação entre os átomos de carbono
Cadeia saturada: só possui ligações simples em sua estrutura.
Cadeia insaturada: possui pelo menos uma ligação dupla ou tripla em sua estrutura.
Quanto a natureza dos átomos que compõem a cadeia
Cadeia homogênea: possui apenas átomos de carbono na extensão da cadeia.
Note que a presença de um átomo diferente de carbono na ponta da cadeia não configura ela como heterogênea.
Cadeia heterogênea: possui a presença de heteroátomos.
Em algumas situações, as cadeias podem ser abertas e fechadas simultaneamente, devido a presença de uma ramificação. Nestes casos, chamamos estas cadeias de mistas.
Em geral, para se classificar uma cadeia, segue-se o seguinte raciocínio:
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf
CLASSIFICAÇÃO DAS CADEIAS CARBÔNICAS:
Exemplos de Cadeias Carbônicas
AULA 5
HIDROCARBONETOS
Muitos estudantes têm medo da Química e, quando escutam a palavra “hidrocarbonetos“, já ficam preocupados. Na verdade, você não tem motivo para se sentir assim. Apesar da quantidade de classificações ser grande, é fácil entender a diferença entre cada um deles. O mais importante é estudar com atenção os conceitos, para não se confundir na hora de prova.
O que são hidrocarbonetos?
Estudamos os hidrocarbonetos dentro da química orgânica.
Os hidrocarbonetos são compostos químicos constituídos primariamente por átomos de hidrogênio e carbono, por meio de ligações covalentes. Além desses dois elementos, também podem haver átomos de nitrogênio, oxigênio, fósforo e enxofre na composição, formando grupos especiais.
Exemplos de hidrocarbonetos
Existem milhares de hidrocarbonetos. Alguns exemplos bem conhecidos são:
- o metano, ou gás natural, usado em veículos;
- o propano e o butano, usados em gás de cozinha;
- o octano, ou gasolina; o etanol, ou álcool etílico, presente em bebidas e perfumes, entre outros produtos;
- a propanona, ou acetona.
Classificação dos hidrocarbonetos
Apesar de todos os hidrocarbonetos compartilharem a mesma definição básica, alguns tipos apresentam características específicas e, assim, formam grupos diferentes. Vamos ver quais são esses grupos?
Alifáticos
Os hidrocarbonetos alifáticos são aqueles em que a cadeia de carbonos é aberta, ou acíclica.
Cíclicos
Os hidrocarbonetos cíclicos são aqueles em que a cadeia de carbonos tem uma formação cíclica. Isso quer dizer que não há “carbonos terminais”. Um hidrocarboneto pode ser cíclico e, ainda assim, ter um átomo de carbono fora do ciclo.
Saturados
Os hidrocarbonetos saturados são aqueles em que as ligações entre os átomos são simples.
Insaturados
Os hidrocarbonetos insaturados são aqueles em que há ligações duplas ou triplas entre os átomos.
Homogênea
Os hidrocarbonetos de cadeia homogênea são aqueles em que não há nenhum átomo diferente de carbono ou hidrogênio.
Heterogênea
Os hidrocarbonetos de cadeia heterogênea são aqueles em que há átomos de outros elementos.
Tipos de hidrocarbonetos
Agora que você já conhece a classificação dos hidrocarbonetos, vamos ainda mais a fundo. Você sabe quais são os principais tipos de hidrocarboneto? Aqui está uma lista com oito deles.
Alcanos
Os hidrocarbonetos alifáticos e saturados são chamados de alcanos.
Alcenos
Os hidrocarbonetos alifáticos e insaturados, que apresentam uma ligação dupla entre seus átomos de carbono, são chamados de alcenos.
Alcinos
Os hidrocarbonetos alifáticos e insaturados, que apresentam uma ligação tripla entre seus átomos de carbono, são chamados de alcinos.
Alcadienos
Os hidrocarbonetos alifáticos e insaturados, que apresentam duas ligações duplas entre seus átomos de carbono, são chamados de alcinos.
Ciclanos
Os hidrocarbonetos cíclicos e saturados são chamados de ciclanos.
Ciclenos
Os hidrocarbonetos cíclicos e insaturados, que apresentam uma ligação dupla entre seus átomos de carbono, são chamados de ciclenos.
Ciclinos
Os hidrocarbonetos cíclicos e insaturados, que apresentam uma ligação tripla entre seus átomos de carbono, são chamados de ciclinos.
Aromáticos
Os hidrocarbonetos cíclicos que são compostos por, no mínimo, um anel de benzeno são chamados de aromáticos. O anel de benzeno é o nome dado à estrutura C6H6 característica do benzeno.
Alguns compostos que não apresentam a estrutura do benzeno também são considerados aromáticos. Eles seguem a Regra de Hückel, segundo a qual o número de elétrons π (pi) é igual a 4n + 2, onde n = 0, 1 , 2, 3…
Nomenclatura de hidrocarbonetos
Para dar nome a uma molécula de hidrocarboneto, você precisa observar sua estrutura. Não deixe de conferir sobre os derivados dos hidrocarbonetos, ok?
Aqui vão os critérios utilizados para a nomenclatura.
Prefixo
O prefixo da nomenclatura está relacionado ao número de carbonos encontrados na cadeia principal da molécula. Os prefixos são:
- 1 carbono: MET
- 2 carbonos: ET
- 3 carbonos: PROP
- 4 carbonos: BUT
- 5 carbonos: PENT
- 6 carbonos: HEX
- 7 carbonos: HEPT
- 8 carbonos: OCT
- 9 carbonos: NON
- 10 carbonos: DEC
Infixo
O infixo da nomenclatura está relacionado ao tipo de ligação encontrada na molécula de hidrocarboneto. Os infixos são:
- Ligações simples apenas: AN
- 1 ligação dupla: EN
- 1 ligação tripla: IN
- 2 ligações duplas: DIEN
- 2 ligações triplas: DIIN
Sufixo
O sufixo é responsável por indicar a função orgânica. No caso dos hidrocarbonetos, o sufixo é sempre “o”.
Exercícios de hidrocarbonetos
A partir dos conceitos que você acabou de ver, que tal praticar com alguns exercícios de fixação sobre hidrocarbonetos? Verifique o quanto você lembra sobre esses compostos, tentando resolver os exercícios abaixo.
Exercício 1
A química orgânica estuda os compostos de carbono e, assim sendo, é importante saber as características básicas deste elemento. Uma das condições mais interessantes é que o carbono é tetravalente, o que significar dizer que:
- Pode formar cadeias com total de quatro outros átomos de carbono
- É capaz de formar ligações quádruplas estáveis
- É capaz de formar quatro ligações covalentes
- Possui um total de oito elétrons em sua camada de valência
Resposta
Letra c.
Exercício 2
Os hidrocarbonetos aromáticos são assim classificados de acordo com alguns critérios conhecidos como critérios de aromaticidade. Identifique entre as alternativas abaixo aquela que se relaciona de modo correto esses critérios.
- Qualquer composto cíclico que possui insaturações é chamado de aromático
- Compostos cíclicos planares que possuem elétrons pi (π) em número par e que seguem a regra de Hückel (4n + 2) π
- Compostos cíclicos que seguem a regra (4n + 2) π, onde n = 0, 1, 2, …
- Apenas o benzeno é classificado como hidrocarboneto cíclico aromático
Resposta
Letra b.


- 2-metil pentano
- 2,2,4-trimetil pentano
- 2,2,5-trimetil hexano
- 4-etil-2,2,3-trimetildecano
- 4-metil pent-1-eno
- 3-metil pent-1-eno
- 3-etil-3-propil heptano
- 2,6-dimetil-5-propil-octano
- 4-terc-butil-4-etil-2,2,3-trimetiloctano
- 4-etil-5-metil hex-2-eno
- 3-isopropil-4,6-dimetil oct-1-eno
- 4-etil-7-metil-5-propil-nonano
- 2, 3-dietil-2, 3-dimetil-hex-4-eno
- 4,4,6-trimetil oct-2-ino
- 2,2,5-trimetil-3-heptino
- 6-etil-2,2,7-trimetl oct-4-eno
- 5-secbutil-2,2,4,6-tetrametil octano
- 2-benzil-3-hexino
- 2-fenil-3-hexino
- 4,5-dimetil oct-2-ino
- 2-metil hex-3-eno
- 2,2,3-trimetil pentano
- 4-fenil but-1-eno
- 4-fenil-3-metil pent-1-eno
- 4-benzil-5-etil hept-2-ino
- 2,6-difenil hept-


