Roteiro Semanal Eja 2 Série
Aula 1
Caro Aluno: Seja bem-vindo ao curso de Química.
Apresentação.
ACORDO PEDAGÓGICO.
Sabemos quanto é difícil para quem trabalha ou procura um emprego, cuida da casa da família se dedicar aos estudos, principalmente quando se parou de estudar há algum tempo.
No entanto os estudantes jovens e adultos têm experiências pessoais que devem ser consideradas no processo de aprendizagem. Trata-se de um conjunto de experiências, conhecimentos e convicções que se formou ao longo da vida. Dessa forma, procuramos respeitar a trajetória daqueles que apostaram na educação como o caminho para a conquista de um futuro melhor.
“A educação é a arma mais poderosa para mudar o mundo, a educação liberta, quem estuda não aceito ser escravo” Nelson Mandela
Esperamos que você conclua o Ensino Médio e, posteriormente, continue estudando e buscando conhecimentos importantes para seu desenvolvimento e sua participação na sociedade. Afinal, o conhecimento é o bem mais valioso que adquirimos na vida e o único que se acumula por toda a nossa existência.
Bons estudos!
O QUE PRECISO FAZER?
Fazer as pesquisas em casa para introduzir o conteúdo, ler o texto com atenção. Assistir vídeo aulas. Na sala de aula faremos discussão e debate do tema e tiraremos as dúvidas.
ESTRATÉGIAS
As aulas são desenvolvidas a partir de um levantamento prévio do conhecimento dos alunos, solicitasse pesquisas sobre o tema para introduzir o conteúdo, utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apóia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos, blog entre outros.
AVALIAÇÃO
• Todas as atividades desenvolvidas pelos estudantes serão avaliadas no processo de aprendizagem:
• 50% pontos (Avaliação atitudinal): responsabilidade, pontualidade, participação em aula, tarefas de casa, comprometimento, empenho em aprender, respeito e tolerância às limitações dos colegas, disciplina, cooperação, frequência, caderno, apostila, pesquisas e trabalho.
• 50% pontos (Avaliação conceitual): prova que será realizada na primeira semana do segundo mês de cada semestre.
RECUPERAÇÕES DA APRENDIZAGEM
O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma.
PESQUISAS PARA INTRODUÇÃO DO CONTEÚDO.
Tema 1 − Água, um bem que precisa ser preservado, água pura, poluída, potável.
Tema 2 – Tipos de concentração e diluição de solução
Tema 3 – Evolução dos modelos atômicos e do átomo.
Tema 4 ‒ O átomo de Bohr, distribuição eletrônica e as ligações químicas
Tema 5 − Funções inorgânicas, Os ácidos, as bases, os sais e os óxidos
NO FINAL DE CADA TEMA, RESPONDER AS QUESTÕES NO CADERNO, A CANETA DEMONSTRADO OS CÁLCULOS.
Esta atividade é para fixação e compreensão dos conceitos para que seja possível a avaliação do conhecimento adquirido ao longo do estudo do tema.
Aula 2
Tema 1 − Água, um bem que precisa ser preservado, água pura, poluída, potável.
A água nossa de cada dia
A água nos parece ser simples demais. Nada mais falso! Com mais de 70 comportamentos fora de série, é um material com inúmeras aplicações.
por Marcia Barbosa

A água é um líquido estranho. Quando olhamos um copo de água gelada, não percebemos os grandes mistérios que este material guarda. Em um mundo altamente tecnológico, ficamos maravilhados com o silício, que possui a propriedade extraordinária de aumentar a sua condutividade ao ser dopado por pequenas quantidades de outro material. Esta propriedade interessante possibilitou a criação dos chips de computador mais de cem anos depois de ter sido observada pela primeira vez. Por outro lado, a água nos parece ser simples demais. Nada mais falso!
Notem: o silício tem somente uma propriedade diferente do que a maioria dos materiais apresenta, por ser um semicondutor, e já é um sucesso; a água tem mais de 70 comportamentos fora de série, e é, portanto, um material com inúmeras aplicações. Ilustremos um destes comportamentos. Se você pegar um cubo de gelo e colocar na água líquida, ele flutua, porque gelo é menos denso do que água. Isto é anormal, pois a fase sólida dos demais materiais é mais densa que sua fase líquida. Uma barra de metal, por exemplo, afunda no metal líquido. Ainda mais espetacular do que gelo flutuar em água, é água a 0º C flutuar em água a 4º C. Assim, no inverno, em locais que alcançam temperaturas negativas, os rios e lagos congelam somente na superfície, permitindo que peixes e plantas sobrevivam no fundo, que está a uma temperatura de 4º C. Isto, inclusive, permitiu que algumas plantas, insetos e pequenos animais tenham sobrevivido a uma das últimas eras glaciais, quando a Terra ficou coberta de gelo.
Outra propriedade fundamental para a vida é o calor específico, Cp, que é quanto calor tem que ser dado para um material aumentar em 1º C a sua temperatura. No caso da água, o Cp tem um valor alto, o que significa que é necessário dar muito calor para a água aumentar em 1º C a sua temperatura. Observamos isso quando vamos a uma piscina para nadar. A água durante um dia quente estará mais fria do que o concreto do piso que contorna a piscina, pois, para aumentar a temperatura da água em 1º C, é necessário fornecer mais calor do que para aumentar a temperatura do concreto. Esta propriedade extraordinária permite que os oceanos não tenham uma variabilidade de temperatura muito elevada, o que igualmente ajuda na manutenção da vida. Mas há coisas bem quotidianas nas quais podemos usar esta propriedade. Se queremos esfriar uma panela de pressão bem quente rapidamente, a colocamos em contato com a água, ao invés de a deixarmos em contato com o ar, pois a capacidade de absorver calor da água é maior do que a do ar. A indústria usa esta anomalia da água – absorver mais calor do que outros materiais – para controle de temperatura.
Além disso, água é um solvente fantástico. Água dissolve bem o sal do nosso sangue e da nossa comida, e o açúcar do nosso café. A água, no entanto, tem seus desafetos. Água detesta compostos apolares (moléculas que, diferentemente da água, são mais democráticas na sua distribuição de elétrons, e não têm acúmulo de cargas em uma dada direção), particularmente óleos. Para resolver este conflito entre água e óleo, é possível usar moléculas surfactantes, como o detergente de cozinha, que une estes dois grandes inimigos. Este jogo de amor e ódio que certos materiais têm com a água tem sua utilidade. Cobrimos o sofá da sala com um polímero que odeia água para que o mesmo não molhe e usamos materiais que amam água para absorver água do ar como, por exemplo, o sal de cozinha – se o deixamos exposto em um dia úmido, ele transforma o vapor de água em água. Isto ocorre porque o sal é polar (tem uma distribuição de carga). Em regiões áridas, se usam polímeros com grupos com cargas para fabricar redes que capturam água do ar .
Mas o que faz com que a água seja assim tão especial? A molécula de H2O em seu formato simples guarda um segredo. O oxigênio, com seus oito elétrons, para se equilibrar eletronicamente precisa de mais dois elétrons, enquanto cada hidrogênio, com somente um elétron, precisa de um elétron a mais para se equilibrar. Para resolver este problema, a natureza criou uma solução socialista, através da negociação perfeita chamada de ligação covalente. O oxigênio empresta um elétron para cada hidrogênio e cada hidrogênio empresta o seu único elétron para o oxigênio. Em média, cada hidrogênio fica com dois elétrons e cada oxigênio com dez elétrons. A ligação covalente, no entanto, não é igualitária. O oxigênio por ter mais prótons, puxa todos os elétrons para a sua vizinhança. Os hidrogênios ficam com os elétrons, mas estes não ficam próximos ao H e sim ao O, ficando a molécula polarizada. Surge assim a “ligação de hidrogênio”.
Enquanto a ligação covalente é entre átomos, a de hidrogênio é entre moléculas, sendo esta última bem mais fraca do que a primeira. Se a ligação covalente é um casamento entre o oxigênio e o hidrogênio, a ligação de hidrogênio é um flerte fortuito entre o hidrogênio de uma molécula e o oxigênio da molécula vizinha. Devido ao formato em V das ligações covalentes, como ilustra a figura 1.
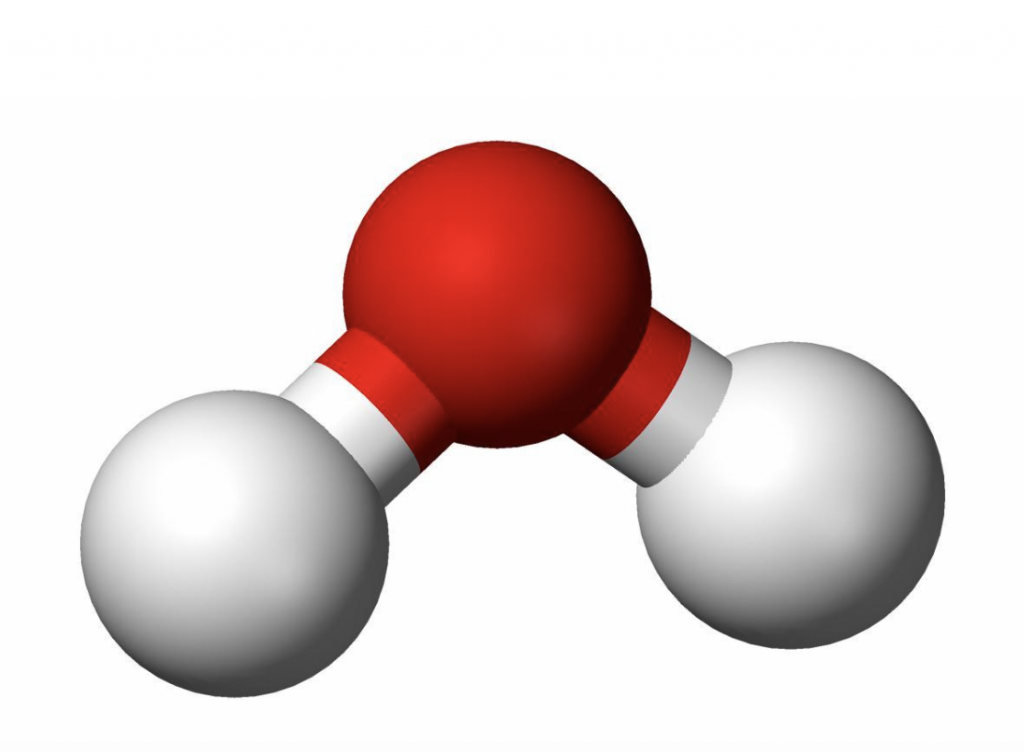
Figura 1 – O oxigênio é representado pela esfera vermelha, e os hidrogênios pelas brancas. (Imagem: Creative Commons)
cada molécula de água pode formar até quatro ligações de hidrogênio. Imagine você estar no centro de um cubo, com os dois braços apontando para dois vértices em diagonais opostas da face superior do cubo e os dois pés apontando para dois vértices em diagonais opostas na face inferior do cubo, alternadas em relação às superiores, como ilustra a figura 2.
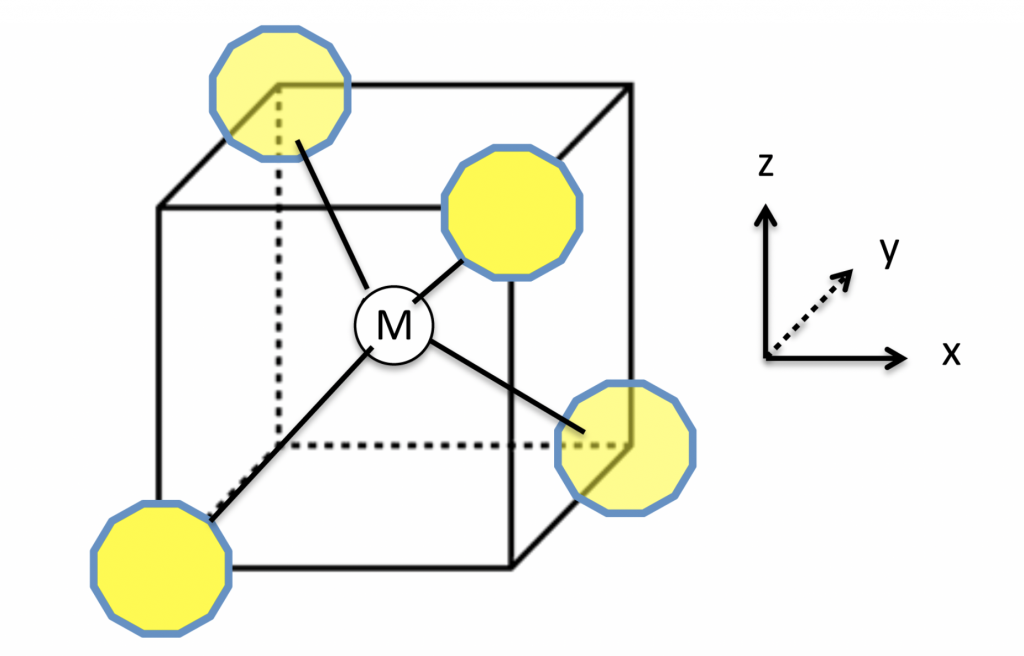
Figura 2 – M representa uma molécula central de água que se liga com outras quatro (em amarelo) através de ligações de hidrogênio com direções e distâncias específicas. (Imagem: Creative Commons)
As quatro ligações de hidrogênio são exatamente assim. Note que elas têm uma distância e ângulo bem precisos. Assim, a baixas temperaturas, o gelo forma todas as ligações possíveis, mas ao aumentar a temperatura algumas ligações são rompidas, o que permite que as moléculas se aproximem, aumentando a densidade e, por isso, o gelo é menos denso que a água a 4º C. A presença das ligações também explica o calor específico elevado, pois é necessário dar calor para romper a ligação e, somente depois de rompida, aumentar a temperatura. Materiais que têm cargas livres, como o sal de cozinha, ou que formam ligações de hidrogênio com a água, como os álcoois, amam a água e se dissolvem bem na água; materiais sem cargas, como os polímeros que usamos para cobrir o sofá da nossa casa, odeiam água e não se solubilizam em água e, por isso, são ótimos para impedir que algo se molhe.
Além de propriedades termodinâmicas, a água se move de maneira peculiar. Na grande maioria dos materiais, a mobilidade das moléculas aumenta com a diminuição da densidade do sistema, pois o espaço para se mover aumenta. Se queremos fazer o óleo fluir mais, aumentamos a temperatura para diminuir a densidade. Na água, no entanto, a baixas temperaturas a mobilidade aumenta com o aumento da densidade. As moléculas de água a altas densidades têm ligações de hidrogênio muito promíscuas que se formam e se desfazem rapidamente, permitindo à água se mover de uma molécula vizinha à outra. A água se comporta como um bando de foliões no carnaval, onde a densidade de pessoas é enorme: as pessoas se movem rapidamente, largando o braço de um companheiro de bloco e passando ao braço de outro. Uma consequência interessante desta alta mobilidade é que se colocarmos a água confinada em tubos muito fininhos (10.000 vezes mais finos do que um fio de cabelo), a água flui através do tubo a uma velocidade que pode ser até 1.000 vezes maior do que se espera para a maioria dos materiais. O que ocorre é que a água confinada em volumes pequenos se move usando a rede de ligações de hidrogênio. Para um tubo bem fininho, as moléculas formam uma linha compacta, que se move como se fosse um tubo dentro de outro tubo como mostra a figura 3. Este fenômeno tem uma aplicação muito importante.
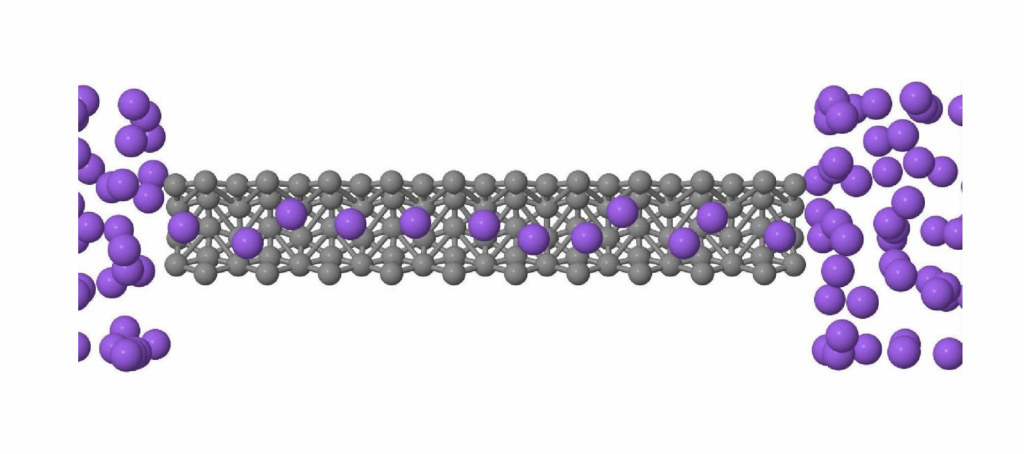
Figura 3 – Nanotubo em cinza e água em roxo. As moléculas fazem uma fila no superfluxo. (Imagem da autora)
Qual a utilidade deste superfluxo? Hoje uma em cada seis pessoas no mundo vive em regiões onde há stress hídrico, ou seja, vivem em regiões que não têm água suficiente para produzir a sua subsistência, e este número em 2030 irá chegar a 50% da população. No Brasil, temos regiões que não têm água suficiente para a sobrevivência, e o crescimento não planejado da agricultura adicionado ao uso indiscriminado de agrotóxicos tem levado a situações de falta de água em regiões como São Paulo. Este quadro, com o crescimento da população, mudança do clima e contaminação da água potável, irá se agravar mundialmente nos próximos anos.
Uma solução que se usa para isso é a dessalinização de água do mar ou salobra. Hoje na Califórnia, em algumas ilhas do Caribe, em diversos países do Oriente Médio e na ilha de Fernando de Noronha, a dessalinização é uma realidade. Uma alternativa é o processo de osmose reversa, usado na Califórnia, que consiste em empurrar a água através de um filtro que permite a passagem de água, mas não a de sal. Este processo é caro e ineficiente, pois as plantas de dessalinização são instalações enormes e se justificam somente para abastecer grandes cidades, pois o processo não tem um equivalente em pequena escala. O defeito deste processo é que não usa nenhuma das propriedades mágicas da água.
Com a descoberta recente do superfluxo da água confinada, alguns pesquisadores têm proposto o uso de nano estruturas para separar a água do sal. A água atravessa os nanotubos de carbono com um superfluxo e o sal, devido à barreira dielétrica da membrana nanométrica, fica fora da membrana. Para que o processo ocorra, os poros devem ter 2 nanômetros de diâmetro, o que por si só é um desafio para a produção em série. A boa nova é que testes laboratoriais realizados na Universidade da Califórnia e testes computacionais realizados por diversos grupos, inclusive o do Instituto de Física da Universidade Federal do Rio Grande do Sul que coordeno, mostraram que este processo seria em ordens de grandeza mais eficiente do que aquele usado atualmente, tornando as plantas de dessalinização mais eficientes, exigindo um consumo menor de energia e filtros menores, ou seja, factíveis para pequenas cidades ou mesmo para bairros. Esperamos que com o desenvolvimento de tecnologias de larga escala para a produção de nanotubos, grafeno ou do MoS2 em quantidade suficiente para construir membranas como a ilustrada na figura 4, em dez anos esta tecnologia esteja implementada no mundo ou, quem sabe se voltarmos a ter um financiamento regular e ininterrupto em ciência e tecnologia, mesmo no Brasil.
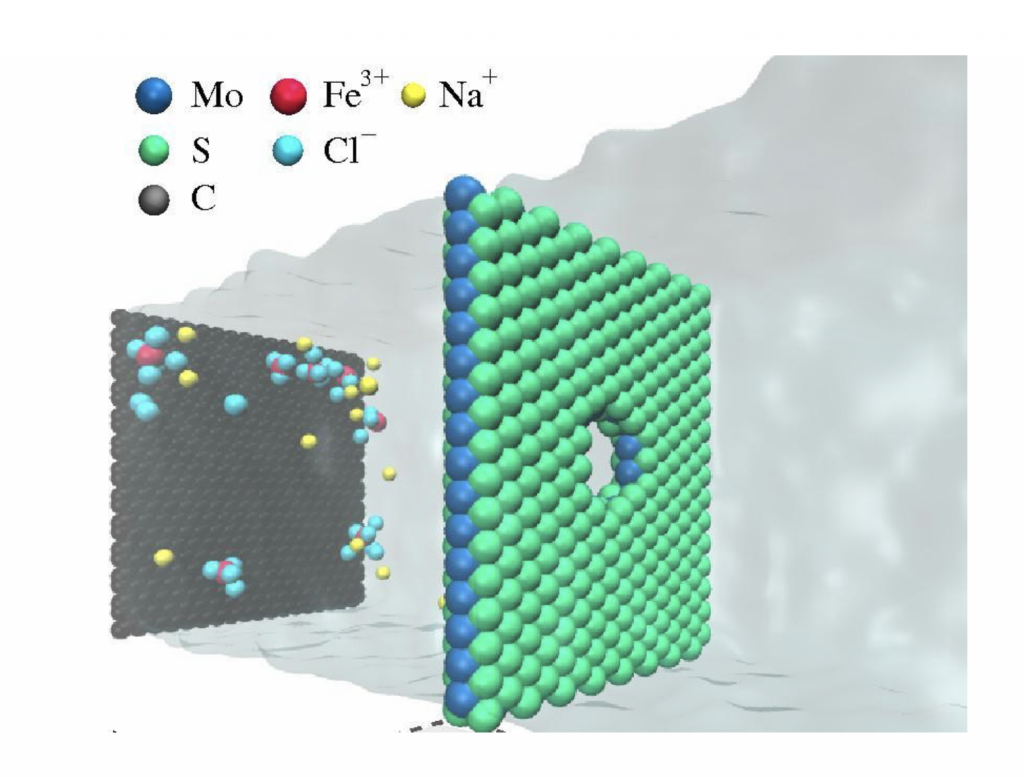
Figura 4 – Sal e água (região sombreada) passando através de uma membrana nanométrica de Dissulfeto de Molibdênio. (Imagem da autora)
Marcia Barbosa é Professora Titular do Instituto de Física da Universidade Federal do Rio Grande do Sul, Bolsista 1B de Produtividade em Pesquisa do CNPq e Diretora na Academia Brasileira de Ciências. Em 2013, recebeu o Prêmio L’Oréal-UNESCO para mulheres na ciência.
Para saber mais:
Página pessoal da Professora Marcia Barbosa.
Vídeo da palestra de Marcia Barbosa na Maratona Piauí Serrapilheira.
Vídeos de simulações realizadas por Marcia Barbosa:
http://www.if.ufrgs.br/~barbosa/a1.5_movie.mp4
http://www.if.ufrgs.br/~barbosa/a4.0_movie.mp4
http://www.if.ufrgs.br/~barbosa/MoS2-NaCl-ferro.mp4
ÁGUA: A IMPORTÂNCIA DO USO CONSCIENTE E FORMAS DE ECONOMIZAR
Água: A importância do uso consciente e formas de economizar
Os reservatórios de água no país são instáveis, pois dependem da chuva e enchem e secam de maneira variável. As Nações Unidas estimam que em 2025, dois terços da população mundial vão sofrer com a escassez de água. É crucial entendermos a importância deste bem precioso, e o fato de que se torna cada vez mais importante economizar água.
- A importância de economizar água
O Brasil é um dos países com a maior quantidade de reservas hídricas que somam cerca de 15% do total de água disponível no planeta. Entre 2014 e 2016, passamos por algumas crises de água, como a do sistema da Cantareira, que fornece água para nove milhões de pessoas. Em 2016, o reservatório sofreu o maior colapso de sua história, atingindo boa parte da população paulista.Segundo o mesmo estudo da ONU (Organização das Nações Unidas) uma pessoa precisa de 110L de água para atender todas as suas demandas diárias, no Brasil, a média da população gasta 200L de água por dia. Lembrando que vivemos em um país onde muitos não tem acesso à água potável diariamente, o que torna nossa média ainda mais preocupante.Poupar água é muito necessário, não apenas quando sua cidade ou seu condômino está em racionamento, e é por isso que nossas dicas podem te ajudar.
- Dicas para economizar água
- Uma das maneiras mais interessantes de poupar água é reutilizá-la!Os resultados gerados são enormes. Reaproveite a água da chuva, banho, máquina de lavar e também a do ar-condicionado, para limpar a calçada, automóveis e usar na descarga de vasos. Para não atrair o mosquito da dengue utilize recipientes com tampas.
- Evite lavar roupa muitas vezes durante a semana, procure acumular quado possível, lavando o máximo de cada vez. O consumo por ciclo de lavagem é em torno de 100L a 132L.
- Parece loucura, mas é possívellavar o carro usando menos de um litro de água, para isso precisamos de panos de microfibra, um pulverizador e shampoo para lavagem de carris. Dilua o produto na água e aplique com o pulverizador na lataria do carro, passe o pano de microfibra para que a sujeira seja absorvida, depois use outro pano que esteja seco para dar brilho.
- Os pulverizadores ou borrifadoressão ótimos na limpeza, pois direcionam a água no local exato a ser higienizado, diminuindo a quantidade a ser usada e rendendo muito mais.
- O gasto usando mangueiras na limpezaé muito grande. O ideal é utilizar baldes, pois esses armazenam melhor a água, otimizando a limpeza e reduzindo o desperdício. Existem algumas linhas com duas águas, que separam a água limpa da suja, além de alguns possuírem o sistema quebra ondas, que ao deslocar o balde reduz o derramamento de água e evita acidentes. Combinando com o pano úmido pode se fazer uma limpeza muito mais prática, eficiente e utilizando somente a quantidade de líquido necessário, não precisando trocar pano
nem fazer esforço.
- Para economizar no banho, desligue o chuveiro ao se ensaboar e diminua o tempo embaixo da ducha. O banho ideal é de 5 minutos, o que equivale a 30 litros de água.
- E não menos importante, não esqueça de economizar na torneira.Não deixe a água correndo enquanto estiver realizando as suas atividades rotineiras, sejam elas: lavar alimentos, escovar os dentes, fazer a barba, tomar banho, lavar louça, etc. É importante que você não esqueça de fechar bem as torneiras, para evitar que elas fiquem gotejando.
- Adote descarga de caixa acopladano vaso sanitário. É importante que você saiba da importância de ter um vaso sanitário que não consuma uma quantidade exacerbada de água. O vaso sanitário com a válvula e tempo de acionamento de 6 segundos gasta cerca de 15 litros. Quando a válvula está defeituosa, pode chegar a gastar mais que o dobro.
- Para detectar vazamentos, busque periodicamente fechar o registro. É importante que você verifique se o relógio continua a contar, isso mostra se suas instalações estão com vazamentos ou não.Vídeo da palestrade Marcia Barbosa na Maratona Piauí Serrapilheira.
É possível viver com a quantidade de água estabelecida pela ONU?
Segundo a ONU (Organização das Nações Unidas), a quantidade de água suficiente para atender as necessidades básicas de um indivíduo é de 110 litros.
No ano de 2013, o consumo médio por pessoa calculado no Brasil era de 166,3 litros por dia, no Rio de Janeiro e Maranhão, por exemplo, esse índice excedia os 200 litros.
Com a crise que se instalou nos últimos meses, a dúvida começou a ser mais discutida: é realmente possível viver com 110 litros de água por dia?
Listaremos agora algumas atividades básicas e o quanto de água é gasto para a realização de cada uma, baseando-se em uma pessoa que mora em casa (os cálculos não são exatamente os mesmos para apartamentos)
Banho – 12 litros de água
Um banho com duração de dois minutos consome aproximadamente 12 litros de água. O ideal é que o chuveiro seja ligado somente para o primeiro enxague do corpo, e depois para retirar o sabonete. Durante o tempo de se ensaboar, utilizar xampu e outras atividades, o chuveiro deve permanecer desligado.
Beber água – 2 litros
O consumo diário recomendado é de 2 litros, mas esse índice varia de pessoa para pessoa.
Descarga – 12 litros
Duas descargas por dia consomem aproximadamente 12 litros no caso de vasos sanitários com caixa acoplada. A dica para economizar é utilizar um balde para que a descarga não seja acionada mais vezes.
Escovar os dentes – 2,7 litros
A torneira deve ser mantida desligada durante todo o tempo da escovação, e deve ser ligada somente para umedecer a escova antes de colocar o creme dental e depois, para limpeza da mesma. O cálculo de consumo é medido levando em conta 5 segundos com a torneira ligada, 3 vezes por dia.
Uma ideia boa é manter um copo com água do lado da pia, assim você pode utilizá-la para enxaguar a boca e reservá-la para alguma outra atividade.
Lavar a louça – 55,2 litros
A torneira da pia ligada por 4 minutos consome 55,2 litros, por isso, na hora de ensaboar a louça, ela deve ser desligada. Outra prática que ajuda a economizar é remover bem o excesso de resíduos dos pratos e copos, assim a lavagem de louça propriamente dita durará menos tempo.
Lavar roupa na máquina – 19 litros
O recomendado é juntar toda a roupa da semana e lavar de uma única vez. O gasto médio é de 135 litros, divididos nos 7 dias, o gasto diário é de 19 litros.
O total é de 102,9 litros, ou seja, é possível sobreviver com a quantidade de água estabelecida pela ONU, e a água acumulada em todas as atividades pode ser utilizada para limpar o chão de casa e fazer faxina nos móveis se necessário.
Fonte: UOL
Aula 3
Semana 20/08 a 21/09
Tema 2 – Tipos de concentração e diluição de solução
CONCENTRAÇÕES DAS SOLUÇÕES
O que são concentrações de soluções químicas?
Concentrações de soluções químicas é a relação entre quantidade de soluto e quantidade de solvente ou de solução. A idéia é bem intuitiva. Um local onde tem muita gente concentrada indica que tem muita gente em um determinado espaço. Perceba que há uma relação de quantidade entre pessoas e espaço.
O mesmo acontece com soluções!
No caso de soluções essas quantidades podem ser expressas em mol, massa ou volume. E aí podem ser feitas as diversas combinações entre mol, massa e volume para obter uma relação de concentração
DEFINIÇÕES
Uma solução é uma mistura homogênea (tipo de mistura onde não é possível distinguir de forma individual cada um dos seus componentes) de um soluto (substância sendo dissolvida) em um solvente (substância que efetua a dissolução).
As soluções são encontradas em quaisquer dos três estados físicos: gasoso, líquido ou sólido. O ar, solução gasosa mais comum, é uma mistura de nitrogênio, oxigênio e quantidades menores de outros gases. Muitas ligas metálicas são soluções sólidas como o “níquel” das moedas (25% Ni, 75% Cu).
As soluções mais familiares estão no estado líquido, especialmente aquelas nas quais a água é o solvente.
Quanto a proporção soluto/solvente, as soluções podem ser diluídas, concentradas, insaturadas, saturadas ou supersaturadas. Podemos descrever uma solução contendo uma pequena quantidade de soluto como diluída e outra, contendo mais soluto na mesma quantidade de solvente como concentrada.
A solução saturada onde a quantidade de soluto é igual ao coeficiente de solubilidade (quantidade limite de soluto que pode ser adicionado a um determinado volume de solvente),as soluções insaturadas são as que possuem quantidade de soluto menor que o seu coeficiente de solubilidade e as super – saturadas apresentam a quantidade de soluto maior que o seu coeficiente de solubilidade, sendo estas muito instáveis e de difícil preparo.
Quanto à condutividade elétrica, as soluções podem ser eletrolíticas ou iônicas. As partículas dissolvidas são íons, bons condutores de eletricidade. É o caso das soluções aquosas de ácidos, bases e sais. E não–eletrolíticas ou moleculares onde as partículas dissolvidas são moléculas não conduzindo eletricidade. É o caso da sacarose em água.
CONCENTRAÇÃO DE SOLUÇÕES
Concentração é o termo que utilizamos para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução. As quantidades podem ser dadas em massa, volume, mol, etc. A concentração de uma solução deve ser expressa em unidades quantitativas. São usadas as chamadas unidades de concentração que são medidas quantitativas da afinidade de soluto que se dissolve. A quantidade relativa de uma substância é conhecida como concentração e é expressa em diferentes unidades.
TIPOS DE CONCENTRAÇÃO
1.Concentração Comum (C)
Também chamada concentração em g/L (grama por litro), relaciona a massa do soluto em gramas com o volume da solução em litros.
Onde:
C = concentração comum (g/L)
m1= massa do soluto(g)
V = volume da solução (L)
Exemplo:
Qual a concentração comum em g/L de uma solução de 3L com 60g de NaCl?
OBS: Concentração comum é diferente de densidade, apesar da fórmula ser parecida. Veja a diferença:
A densidade é sempre da solução, m2 então:
Na concentração comum, calcula-se apenas a m soluto, ou seja, m1
Cada grandeza tem um índice. Utilizamos índice:
1 = para quantidades relativas ao soluto
2 = para quantidades relativas ao solvente
nenhum índice = para quantidades relativas à solução
m=m1+m2
- Densidade
Densidade é a massa por unidade de volume de uma substância. O cálculo da densidade é feito pela divisão da massa do objeto por seu volume.
(UFU-MG) Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm3. A massa desse metal, da qual um garimpeiro de Poconé (MT) necessita para encher completamente um frasco de meio litro de capacidade, é de?”
Resolução:
Dados:
dmercúrio = 13 g/cm3
V = 0,5 L = 500 mL = 500 cm3
m = ?
Da fórmula da densidade, temos:
d = m/V
m = d . V
m = (13 g/cm3) . (500 cm3)
m = 6500 g
Por exemplo, digamos que você quer descobrir a densidade de um pedaço de ferro de forma irregular. Depois de determinar a massa desse objeto, você determinará o volume dele fazendo o seguinte:
- Coloque determinado volume de água em uma proveta;
- Depois pegue o pedaço de ferro e coloque-o totalmente submerso nessa proveta;
- Observe qual foi a diferença no volume da água. Pronto! Esse é o volume do sólido!
Por exemplo, digamos que a massa “pesada” deu igual a 39,5 g e que o volume de água na proveta aumentou de 50 mL para 55 mL, então a diferença do volume, isto é, 5 mL, corresponde ao volume do pedaço de ferro. Calculando a densidade dele, temos:
d = m
V
d = 39,5 g
5 mL
d = 7,9 g/mL
Essa é exatamente a densidade do ferro a 20ºC.
Pode-se dizer também que quanto menos o volume de água for deslocado, menos denso é o objeto.
* Créditos da imagem: Lefteris Papaulakis / Shutterstock.com
http://manualdaquimica.uol.com.br/quimica-geral/densidade.htm
-
Título ou Porcentagem em massa de uma solução
É a relação (razão) entre a massa do soluto e a massa da solução. Ele não tem unidades e pode ser expresso também em porcentagem. Nesse caso é só multiplicar o resultado por 100%. Além disso, existe a porcentagem em volume da solução
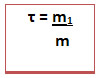
A massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente (m = m1 + m2).
O título é adimensional, isto é, um número puro e sem unidades. No entanto, se você quiser expressar essa relação em porcentagem em massa (τ%), basta multiplicar o resultado por 100%.

Assim, quando dizemos que determinada solução possui título igual a 0,35, isso significa que para cada unidade de massa da solução há 0,35 unidade de massa de soluto e 0,65 unidade de massa de solvente.
Um exemplo bastante comum do uso da porcentagem no cotidiano ocorre em soluções aquosas, como é o caso do soro fisiológico. O soro fisiológico é uma solução de NaCl (cloreto de sódio – sal de cozinha), que apresenta uma porcentagem em massa de 0,9 %. Isso significa que existem 0,9 grama de NaCl para cada 100 gramas de solução. Assim, podemos concluir que seu título é 0,009.

O exemplo é uma solução líquida, mas o título é usado para exprimir a concentração em qualquer estado de agregação (sólido, líquido ou gasoso).
No caso de soluções em que todos os componentes são gasosos ou são líquidos é possível também calcular o título em volume (τv), por relacionar o volume do soluto com o volume da solução (v), segundo a fórmula:
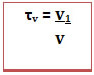
O título em volume também pode ser expresso em porcentagem:
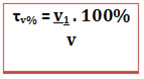
A diferença que existe quando se trabalha com o título em volume é que no título em massa, conforme dito anteriormente, a massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente. Já aqui isso não é possível, isto é, não podemos somar o volume do soluto com o volume do solvente para obter o volume da solução. Isso ocorre porque as forças intermoleculares existentes entre esses líquidos alteram os seus volumes quando se misturam. Portanto, o volume da solução deve ser medido experimentalmente ou fornecido no exercício.
Por exemplo, a seguir temos a imagem de um frasco de álcool etílico que indica a porcentagem em volume de 96%. Isso quer dizer que em cada 100 unidades de volume da solução, 96 unidades são do álcool e apenas 4 são de água.
.jpg)
Publicado por: Jennifer Rocha Vargas Fogaça em Soluções
Título ou Porcentagem em massa de uma solução
-
Partes por Milhão (ppm)
Concentração PPM Partes por milhão ou abreviadamente ppm é a medida de concentração que se utiliza quando as soluções são muito diluídas. Concentrações ainda menores podem ser expressas em partes por bilhão (ppb), partes por trilhão, etc, no que se chama partes por notação, da qual a ppm é a mais usual.

Quando a concentração de uma solução (principalmente líquidas e gasosas) é dada em valores extremamente pequenos, costuma-se utilizar a unidade parte por milhão (ppm).
A concentração de soluções químicas refere-se à quantidade de soluto que existe em uma quantidade padrão de solução ou em uma quantidade padrão de solvente. Assim, a concentração em partes por milhão pode ser definida da seguinte maneira:
* Partes por milhão (ppm): Indica quantas partes de soluto (em massa ou em volume) existem em um milhão (1 000 000 ou 106) de partes da solução (também em massa ou em volume).
Isso significa que podemos descobrir o ppm pela seguinte expressão matemática:
x ppm = __x parte do soluto__
106 partes de solvente (solução)
Visto que a quantidade de soluto é extremamente pequena, nos cálculos que utilizam a fórmula acima, o volume ou a massa da solução serão considerados exatamente os mesmos do solvente, ou seja, se soubermos que uma solução aquosa de permanganato de potássio (KmnO4(aq)) tem concentração de 70 ppm, isso significa que existem 70 g de permanganato em 1 milhão de gramas da solução ou de água, conforme mostra a fórmula:
70 ppm = _70 g do permanganato_
106 g de água
Tendo em vista que:
106 g = 1 t;
10-3 g = 1 mg;
103 g = 1 kg;
10-6 g = 1 μg.
Podemos fazer então o cálculo usando também as seguintes relações:
* 1 ppm = 1 g do soluto__
1 t de solvente (solução)
* 1 ppm = 1 mg do soluto__
1 kg de solvente (solução)
* 1 ppm = 1 μg do soluto__
1 g de solvente (solução)
Relações similares podem ser feitas com as unidades de volume:
* 1 ppm = 1 L do soluto__
1000 m3 de solvente (solução)
* 1 ppm = 1 mL do soluto__
1 m3 de solvente (solução)
* 1 ppm = 1 μL do soluto__
1 L de solvente (solução)
* 1 ppm = 1 mL do soluto__
1000 L de solvente (solução)
Também podemos relacionar massa e volume em soluções, por exemplo, que são formadas por um soluto sólido dissolvido em um solvente líquido:
* 1 ppm = 1 g do soluto__
1000 L de solvente (solução)
* 1 ppm = 1 mg do soluto__
* 1 ppm = 1 μL do soluto__
1 mL de solvente (solução)
Assim como ppm significa “partes por milhão”, ppb significa “partes por bilhão”, e ppt é “partes por trilhão”:
x ppb = __x parte do soluto__
109 partes de solvente (solução)
x ppt = __x parte do soluto__
1012 partes de solvente (solução)
Essas concentrações tão pequenas são aplicadas principalmente quando se trabalha com dados referentes à poluição do ar e da água. Veja abaixo uma tabela que mostra os principais gases-estufa presentes na atmosfera terrestre e a sua abundância (dados de 1998):
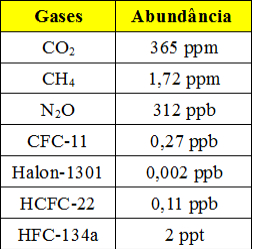
Tabela com abundância de gases-estufa na atmosfera
Esse é um exemplo que mostra que o uso desse tipo de concentração é importante tanto para estabelecer um limite máximo para esse e outros poluentes quanto para monitorá-los. Também pode ser usado em cosméticos e produtos de limpeza e higiene pessoal para mostrar a quantidade de seus constituintes.
Veja agora dois exemplos de exercícios envolvendo o cálculo da concentração de soluções em ppm e ppb:
Exemplo 1: (Fatec-SP) No rótulo de uma garrafa de água mineral lê-se, entre outras informações:
Conteúdo: 1,5 litro;
Nitrato de sódio: 6,0 ppm.
Considere que 1 ppm equivale a 1 mg de soluto por litro de solução aquosa. A massa de nitrato de sódio ingerida por uma pessoa que bebe um copo 300 mL dessa água é?
a) 0,003 g b) 0,0018 g c) 9,0 g d) 6,0 mg e) 1,2 mg
Resolução:
1 mg de nitrato de sódio (1 ppm) ——- 1 L
6 mg de nitrato de sódio (6 ppm) ——- 1000 mL
x————————– 300 mL
x = 300 . 6
1000
x = 1,8 mg de nitrato de sódio
1 g —– 1000 mg
y——– 1,8 mg
y = 1,8 . 1
1000
y = 0,0018 g de nitrato de sódio
A alternativa correta é a letra “b”.
Exemplo 2: (Fatec-SP) Uma das formas de medir o grau de intoxicação por mercúrio em seres humanos é a determinação de sua presença nos cabelos. A Organização Mundial de Saúde (OMS) estabeleceu que o nível máximo permissível, sem risco para a saúde, é de 50 ppm, ou seja, 50. 10-6 g de mercúrio por grama de cabelo. Forneça a expressão dessa concentração em ppb.
Resolução:
1 bilhão = 109.
50 partes de mercúrio —- 106 partes de cabelo
x——————————109 partes de cabelo
x = 109 . 50
106
x = 5 . 104 ppb
Por Jennifer Fogaça
Graduada em Químic
http://manualdaquimica.uol.com.br/fisico-quimica/partes-por-milhao-ppm.htm
Concentração em mol/L Molaridade (M)
A molaridade de uma solução é a concentração em número de mols de soluto e o volumede 1L de solução.
Onde:
M = molaridade (mol/L)
n1= número de mols do soluto (mol)
V = volume da solução (L)
Concentração é o termo que utilizamos para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução.
As quantidades podem ser dadas em massa, volume, mol, etc.
Observe:
m1= 2g
n2 = 0,5mol
V = 14L
Exemplos:
massa de 2g do soluto NaCl: m1= 2g
número de mols de 0,5mol do solvente água: n2 = 0,5mol
volume da solução de 14L: V = 14L
Em laboratório, é muito importante conhecer a concentração em mol/L das soluções químicas
A concentração em mol/L (M) é também muito conhecida como Concentração Molar, e também Molaridade. No entanto, esses nomes, apesar de bastante difundidos, não são recomendados pela SBQ (Sociedade Brasileira de Química). Os nomes corretos são Concentração em mol/L ou Concentração em quantidade de matéria.
Em laboratórios e indústrias químicas, essa é a concentração mais utilizada, pois é a recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional da Química Pura e Aplicada (IUPAC). É uma relação mais sofisticada que a concentração comum.
Seu cálculo é feito dividindo-se a quantidade de matéria ou substância (mol) pelo volume da solução, conforme a expressão matemática abaixo:
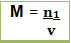
Onde M = concentração em mol/L
n1 = número de mols do soluto (mol), lembrando que o índice 1 indica grandezas relacionadas ao soluto
v = volume da solução (L)
Desse modo, se for dito que uma solução tem concentração de 4,5 mol/L, quer dizer que em cada litro da solução (não do solvente) tem-se dissolvidos 4,5 mols do soluto.
Porém, em laboratório é mais fácil conseguir a massa em gramas do soluto e a sua massa molar, do que a sua quantidade de máteria em mols. Assim, sabendo-se que:
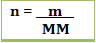
ou se referindo ao soluto:

Podemos substituir o valor de n1 na fórmula da concentração em mol/L e teremos:

Considere o problema abaixo para ver como se usa essa fórmula a fim de determinar a concentração de uma solução:
“Qual será a concentração em quantidade de matéria de uma solução que foi preparada dissolvendo-se 120 g de hidróxido de sódio em 2 L de água e obteve-se uma solução com 2 L?”
Dados:
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol
• Substituindo os valores dados na fórmula:
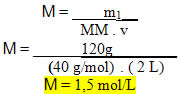
Publicado por: Jennifer Rocha Vargas Fogaça
http://mundoeducacao.bol.uol.com.br/quimica/concentracao-mol-l.htm
- DBO
Significa Demanda Bioquímica de Oxigênio, ou seja, é a quantidade de oxigênio necessária para estabilizar a matéria orgânica.
A DBO é o parâmetro tradicionalmente mais usado para a caracterização de águas residuárias brutas e tratadas, como também para a caracterização da qualidade dos corpos d’água. A quantidade de matéria orgânica presente, indicada pela DBO, é importante para se conhecer o potencial poluidor de um efluente, para o dimensionamento do sistema de tratamento mais adequado e medir a eficiência desse sistema. Quanto maior o grau de poluição orgânica, maior a DBO do curso d’água.
DBOe = [Lo.(Qe + Qr) – DBOr x Qr] / Qr
Onde: DBOe = concentração máxima de DBO no efluente a ser lançado (mg L-1);
Lo. = DBO da mistura água do rio + efluente, no ponto de lançamento (mg L-1);
Sendo: Lo. = (DBOr x Qr + DBOe x Qe)/(Qr + Qe)
Qe = vazão do efluente no ponto de lançamento (L s-1);
Qr = vazão do rio no ponto de lançamento (L s-1);
DBOr = concentração de DBO na água do rio, a montante do’lançamento (mg L-1).
P.S.: mg/L = ppm
O que é Demanda Bioquímica de Oxigênio?
A função principal do nosso sistema de tratamento é receber o efluente e submete-lo a um processo biológico, tendo como objetivo minimizar a sua quantidade de D.B.O existente. Mas o que é D.B.O?
D.B.O. significa Demanda Bioquímica de Oxigênio, ou seja, é a quantidade de oxigênio necessária para estabilizar a matéria orgânica. Quanto menor o nível de DBO, menos poluente é o efluente.
Para efeitos comparativos: A água pura tem 10ml/L de oxigênio dissolvido;
Peixes sensíveis precisam de 5 a 6 ml/L de oxigênio para sobreviverem, enquanto que peixes mais resistentes, como o bagre, sobrevivem em 2 a 3 ml/L de oxigênio dissolvidos na água;
O esgoto doméstico precisa, para ser degradado, de aproximadamente 300ml/L de oxigênio (DBO). Após tratamento com o sistema Delta Ambiental, o efluente resultante tem em torno de apenas 30 ml/L de DBO, não causando danos ao meio ambiente se for disposto corretamente e atendendo as exigências legais.
O valor da Demanda Bioquímica de Oxigênio (DBO), é usado para estimar a carga orgânica dos efluentes e dos recursos hídricos, com esse valor é possível identificar a necessidade de aeração (oxigenação) para degradar essa materia orgânica nas ETE’s (Estações de Tratamento de Esgoto).
Demanda bioquímica de oxigênio é o parâmetro mais utilizado para a medida do consumo de oxigênio na água. Representa a quantidade de oxigênio do meio que é consumido pelos peixes e outros organismos aeróbicos e que gasta de oxidação de matéria orgânica presente na água. É medida a 20º C.
http://https:mundoeducacao.bol.uol.com.br/quimica/demanda-bioquimica-oxigenio.htm
Aula 4
DILUIÇÃO DE SOLUÇÕES
Fazemos uma diluição quando adicionamos mais solvente a uma solução já existente, de modo que a concentração da solução diminua.
No cotidiano é muito comum realizarmos diluições. Por exemplo, geralmente os rótulos de sucos concentrados indicam que o preparado desses sucos deve ser feito acrescentando-se água numa proporção determinada. Quando fazemos isso, estamos diluindo o suco
Atenção: Não confunda diluição com dissolução. Quando estamos fazendo um suco e adicionamos o soluto (refresco em pó, por exemplo) ao solvente (água), está ocorrendo uma dissolução. Mas quando acrescentamos mais água a uma solução de água com refresco em pó, temos uma diluição.
Essa prática também é muito comum nos laboratórios, pois geralmente as soluções que são comercializadas vêm numa concentração bem alta e, de acordo com a finalidade, os cientistas preparam soluções mais diluídas a partir da solução inicial.
Essas soluções costumam ser preparadas pegando-se uma alíquota, isto é, uma parte da solução inicial com uma pipeta, que é um instrumento utilizado para medir e transferir volumes de líquidos com alta precisão. Essa alíquota é transferida para um balão volumétrico e, por último, acrescenta-se a água até atingir o volume desejado e indicado pelo balão volumétrico.
Mas surge uma pergunta: Como saber o volume da alíquota que se deve pegar para preparar a solução?
Bem, isso depende de qual concentração queremos que a solução tenha. Quando realizamos uma diluição, a massa do soluto permanece inalterada, como mostra a imagem abaixo:
No entanto, a massa do solvente mudou e, consequentemente, a massa e a concentração da solução também mudaram. Tendo em vista que a fórmula da concentração comum é dada pela divisão entre a massa do soluto pelo volume da solução, temos o seguinte:
Cinicial = __m1__ Cfinal = __m1__
Vinicial Vfinal
m1 = Cinicial . Vinicial m1 = Cfinal . Vfinal
Cinicial . Vinicial = Cfinal . Vfinal
Por meio dessa relação é possível determinar a concentração da solução final. Veja um exemplo abaixo:
“500 mL de água foram adicionados a uma solução aquosa de ácido sulfúrico (H2SO4(aq)) de volume inicial igual a 200 mL e concentração de 20 g/L. Qual a concentração da solução após essa diluição?”
Resolução:
Dados:
Se a concentração inicial era de 20 g/L, isso significa que em cada litro da solução há 20 gramas de soluto (ácido sulfúrico) dissolvido. Assim, basta fazer uma regra de três para descobrir qual a massa do soluto que está dissolvida em 200 mL (0,2 mL) da solução:
20 g de ácido sulfúrico ——— 1 L de solução
m1 ——— 0,2 L
1 . m1 = 0,2 . 20
m1 = 4 g
Agora, para descobrir a concentração final basta usar a expressão abaixo:
Cinicial . Vinicial = Cfinal . Vfinal
(20 g/L) . 0,2 L = Cfinal . (0,2 L + 0,5 L)
Cfinal = _4g_
0,7L
Cfinal = 5,7 g/L
A mesma relação pode ser feita com a concentração em mol/L, com o título em massa e com a fração molecular, como mostra a tabela abaixo:
EXERCÍCIOS DE FIXAÇÃO COPIAR E RESPONDER AS QUESTÕES NO CADERNO, A CANETA DEMONSTRADO OS CÁLCULOS, ALCUNS ESTÃO COM A RESPOSTA
Esta atividade é para fixação e compreensão dos conceitos para que seja possível a avaliação do Conhecimento adquirido ao longo do estudo do Tema.
1)Dissolve-se 20 g de sal de cozinha em água. Qual será o volume da solução, sabendo-se que a sua concentração é de 0,05 g/L?
2)FAAP-SP- modificada) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contém 30 g de sal em 400 mL de solução.
3)Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?
4)Um técnico de laboratório preparou uma solução aquosa de ácido sulfúrico (H2SO4) misturando 33 g desse ácido em 200 mL de água, com extremo cuidado, lentamente, sob agitação e em uma capela com exaustor. Ao final, a solução ficou com um volume de 220 mL. A concentração em g/L dessa solução é:
5)(Unicamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de MgCl2 de concentração 8,0 g/L. Quantos gramas de soluto são obtidos?
6)Qual a concentração de uma solução contendo 40g de cloreto de sódio dissolvidos em 250 mL de solução? R:160
7) Uma solução foi preparada adicionando-se 40g de hidróxido de sódio em água suficiente para produzir 200 mL de solução. Calcule a concentração comum dessa solução. R:200
8) Calcule a concentração comum de uma solução de nitrato de prata, sabendo que ela encerra 120g do sal em 600 cm3 de solução. R:200
9)Determine a massa de ácido nítrico, em gramas, necessária para a preparação de 150 mL de uma solução de concentração 50g/L. R:7,5g
10) (Faap-SP) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contêm 30g de sal em 400 mL de solução. R:7,5
11) (Mack-SP) Qual a concentração, em g/L, da solução obtida ao se dissolverem 4g de cloreto de sódio em 50 cm3 de solução? R:80
12) São dissolvidos 24g de sacarose em água suficiente para 500mL de solução. Qual é a concentração comum dessa solução? R:48
13) Calcule a concentração comum de uma solução que apresenta volume de 800mL e contém 80g de soluto. R:100
14) (PUCCamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de cloreto de magnésio de concentração 8,0g/L. Quantos gramas de soluto são obtidos? R:2
15) São dissolvidos 200g de cloreto de sódio em água suficiente para 2 litros de solução. qual é a concentração comum dessa solução? R:100
16) 300g de açúcar foram adicionados a uma certa quantidade de água, obtendo-se uma solução 60g/L. Qual o volume dessa solução, em mL? R:5000
17) A concentração comum de uma solução é de 20g/L. Determine o volume, em mL, dessa solução, sabendo que ela contém 75g de soluto. R:3750
18) (UFSM-RS) O derramamento de óleo nos cursos d’água forma uma película que dificulta a absorção de oxigênio, o que provoca a destruição de algas e plânctons, prejudicando a alimentação dos peixes. De acordo com alguns órgãos ambientais, o limite máximo de óleo na água é de 30mg/L. Com base nesse parâmetro, quantos gramas de óleo poderão estar presentes em 1m3 de água, sem comprometer o ecossistema? R:30
19)Determine a massa de NaOH, em gramas, dissolvido em água suficiente para 300mL de solução, cuja concentração comum é de 700g/L. R:210
20) Um frasco de laboratório contém 2,0 L de uma solução aquosa de NaCl. A massa do sal dissolvida na solução é de 120g. Que volume, em L, deve ser retirado da solução inicial para que se obtenham 30g de sal dissolvido? R:0,5
21) (USJT-SP) O oxalato de cálcio é encontrado nas folhas de espinafre, nas sementes do tomate, e é um dos constituintes das pedras formadas nos rins (cálculo renal). Uma amostra (alíquota) de 25 cm3 de uma solução aquosa de oxalato de cálcio contém 0,2625g desse sal. Qual é a concentração comum de oxalato nessa solução? R:10,5
22) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de MgCl2 de concentração 8,0 g/L. Quantos gramas de MgCl2 são obtidos? Resposta: 2g
23)Uma solução foi preparada adicionando – se 40 g de NaOH em água suficiente para produzir 400 mL de solução. Calcule a concentração da solução em g/L. Resposta: 10 g/L
24)O ser humano adulto possui, em média, 5 litros de sangue com cloreto de sódio ( NaCl ) dissolvido na concentração de 5,8 g/L. Qual é a massa total de cloreto de sódio ( NaCl ) no sangue de uma pessoa adulta? Resposta: 29 g
25) Qual a concentração, em g/L, de uma solução resultante da dissolução de 50g de NaCl para um volume final de 200mL? Resposta: 250 g/L
26) Qual o volume final que deve ter uma solução para que tenha concentração igual a 10g/L a partir de 25g de soluto? Resposta: 2,5 L
27) Nosso suco gástrico é uma solução aquosa de HCl( ácido clorídrico ), com massa de 0,365 g para cada 1 litro. Com base nessa informação, determine a concentração molar (molaridade, mol/L ) do ácido clorídrico no suco gástrico.( Dado: massa molar do HCl = 36,5 g/mol). Resposta: 0,01 mol/L
28) Considere uma xícara com 200 mL de leite, ao qual se acrescentaram 6,84 g de açúcar comum. Qual será a concentração molar (molaridade), expressa em mols/ L, da solução formada? ( Dado: massa molar do açúcar comum (C12H22O11) = 342 g/mol.) Resposta: 0,1 mol/L
29) Em um balão volumétrico de 400 mL, são colocados 18 g de KBr e água suficiente para atingir a marca do gargalo (ou seja, completar 400 mL de solução). Qual é a concentração molar (quantidade de matéria por volume) dessa solução? (Dado: massa molar KBr=119g) Resposta: 0,37 mol/L
30)Qual a concentração de uma solução contendo 40g de cloreto de sódio dissolvidos em 250 mL de solução? R:160
31) Uma solução foi preparada adicionando-se 40g de hidróxido de sódio em água suficiente para produzir 200 mL de solução. Calcule a concentração comum dessa solução. R:200
32) Calcule a concentração comum de uma solução de nitrato de prata, sabendo que ela encerra 120g do sal em 600 cm3 de solução. R:200
33)Determine a massa de ácido nítrico, em gramas, necessária para a preparação de 150 mL de uma solução de concentração 50g/L. R:7,5g
34) (Faap-SP) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contêm 30g de sal em 400 mL de solução. R:7,5
35) (Mack-SP) Qual a concentração, em g/L, da solução obtida ao se dissolverem 4g de cloreto de sódio em 50 cm3 de solução? R:80
36) São dissolvidos 24g de sacarose em água suficiente para 500mL de solução. Qual é a concentração comum dessa solução? R:48
37) Calcule a concentração comum de uma solução que apresenta volume de 800mL e contém 80g de soluto. R:100
38) (PUCCamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de cloreto de magnésio de concentração 8,0g/L. Quantos gramas de soluto são obtidos? R:2
39) São dissolvidos 200g de cloreto de sódio em água suficiente para 2 litros de solução. qual é a concentração comum dessa solução? R:100
40) (UFSM-RS) O derramamento de óleo nos cursos d’água forma uma película que dificulta a absorção de oxigênio, o que provoca a destruição de algas e plânctons, prejudicando a alimentação dos peixes. De acordo com alguns órgãos ambientais, o limite máximo de óleo na água é de 30mg/L. Com base nesse parâmetro, quantos gramas de óleo poderão estar presentes em 1m3 de água, sem comprometer o ecossistema? R:30
Aula 4
Introdução
Embora em lugares do interior do Brasil ainda existam comunidades que vivem sem energia elétrica, não há como negar que se depende muito dela. Sua falta acarreta, geralmente, um enorme transtorno. O conhecimento dos fenômenos elétricos e seu domínio contribuíram (e ainda contribuem) como avanço das ciências, além de ter permitido a melhora na qualidade de vida das pessoas.
O QUE VOCE JÁ SABE?
Ao pentear os cabelos em dias secos, é comum que os fios fiquem “rebeldes”, levantando e grudando no pente. Você já viu esse fenômeno acontecer? Já pensou sobre ele?
Os fenômenos elétricos são conhecidos desde a Antiguidade. Em 600 a.C.,o filósofo grego Tales de Mileto observou que uma resina natural,o âmbar, depois de entrar em atrito com a lã, atraí apenas e cascas de cereais. Assim, com a observação dessas forças de atração e repulsão, iniciaram-se os primeiros estudos dos fenômenos elétricos. O conhecimento das características das cargas elétricas foi determinante no desenvolvimento dos modelos atômicos.
Agora, você vai iniciar o estudo sobre os fenômenos elétricos realizando alguns experimentos. É recomendável fazê-los em um dia em que a umidade do ar esteja baixa, ou seja, em um dia “seco”. Você vai precisar de:
- Dois bastões de plástico, que podem ser canetas esferográficas sem a carga e a tampa;
- um bastão de vidro;
- um pedaço de tecido de lã;
- um pedaço de papel-alumínio;
- uma bolinha de isopor;
- linhas de costura;
- um suporte.
Cubra a bolinha de isopor com uma camada de papel-alumínio e pendure-a no suporte, como mostra a figura ao lado (passo 1). Atrite (esfregue) o bastão de vidro com o tecido de lã e aproxime-o da bolinha, sem encostar (passos 2 e 3). Observe o que ocorre. Repita o mesmo procedi- mento com o bastão de plástico (passos 4 e 5). Observe o queacontece.
Como você deve ter notado, os dois bastões, quando atritados com o tecido de lã, atraem a bolinha e, depois, a repelem.
Experimento sobre eletrização II
Agora, como mostram as figuras da próxima página, você deve começar atritando o bastão de vidro com o tecido de lã (passo 1). Pendure o bastão de plástico e aproxime dele o bastão de vidro, sem encostar (passo2). Anote o que observou.
Repita o procedimento anterior só que, dessa vez, deixe o bastão de vidro de lado e utilize um outro bastão de plástico. Atrite-o com o tecido de lã e aproxime-o do bastão de plástico que está pendurado no suporte, sem encostar (passos 3 e 4). Observe o que ocorre.
No primeiro caso, percebe-se que o bastão de vidro atrai o bastão de plástico. No segundo, quando os dois bastões de plástico se aproximam um do outro, eles se repelem.
Como explicar o que ocorre nos experimentos?
O fenômeno observado foi explicado já no século XVIII, considerando-se que no bastão de vidro surge uma carga elétrica, que foi chamada de carga vítrea, e no bastão de plástico, uma carga elétrica, que foi chamada de carga resinosa; na época, o bastão era de âmbar, uma resina. Mais tarde, por convenção, a carga vítrea passou a ser chamada carga positiva, e a carga resinosa, carga negativa. Depois do atrito do bastão de vidro com o tecido de lã, ele adquire cargas positivas e a lã adquire cargas negativas; no caso do atrito do bastão de plástico com a lã, ele adquire cargas elétricas negativa se a lã fica positivamente carregada.
Uma das características das cargas elétricas é que cargas iguais se repelem e cargas diferentes se atraem, ou seja, cargas positivas são repelidas pelas cargas positivas e atraídas pelas cargas negativas, e vice-versa.
Toda matéria é formada por cargas positivas e negativas, na mesma quantidade, o que dá o caráter neutro dos materiais. Assim, ao aproximar a bolinha dos bastões carregados, ela é eletrizada e sofre atração pelos bastões, não importando de que material eles são, como a ilustração a seguir mostra:
Experimento sobre eletrização I.
Como pode ser observado na ilustração, a bolinha está com carga neutra por apresentar o mesmo número de cargas elétricas positivas e negativas. Ao se aproximar um bastão carregado, as cargas elétricas da esfera se separam e ela é atraída. Se o bastão estiver carregado positivamente, as cargas positivas dele repelem as cargas positivas da bolinha e atraem suas cargas negativas. O mesmo ocorre se você aproximar o bastão de plástico (ou a caneta) carregado negativa- mente: suas cargas negativas repelem as cargas negativas da bolinha e atraem as positivas. Quando se afasta da bolinha o bastão (de plástico ou de vidro), as cargas se redistribuem e ela recupera sua neutralidade. Se qualquer um dos bastões encostar-se à bolinha, ela vai adquirir a carga dele, sendo, então, repelida Agora, você vai iniciar o estudo sobre os fenômenos elétricos realizando alguns experimentos. É recomendável fazê-los em um dia em que a umidade do ar esteja baixa, ou seja, em um dia “seco”.
Aula 5
A Evolução do Átomo
O Átomo Maciço de John Dalton
John Dalton foi Físico Inglês nascido na cidade de Eaglesfield, Cumberland no ano de 1766 e faleceu na cidade de Manchester no ano de 1844. Na sua teoria Dalton chegou à seguinte conclusão: toda a matéria existente é formada por átomos que são partículas extremamente pequenas, são esferas maciças, homogêneas, indivisíveis, indestrutíveis, e de carga eletricamente neutra. Cada átomo possui o seu próprio símbolo, e cada elemento possui propriedades características físicas e químicas diferentes. Um composto pode ser formado pela combinação de dois ou mais átomos.
Para maiores informações pesquisar:
pt.wikipedia.org/wiki/John_Dalton
O Átomo Corpuscular de Thomson
O físico britânico Joseph John Thomson nasceu em Cheethan Hill perto de Manchester no ano de 1956 e faleceu no ano de 1940 na cidade de Cambridge. Foi o inventor de um aparelho chamado de espectrógrafo de massa que permitia medir a massa dos átomos. Nas suas pesquisas, em 1898 sugeriu que o átomo deveria ser uma pequena esfera de massa positiva com elétrons de carga negativa incrustados na massa dessa esfera. Foi o descobridor da partícula negativa do átomo o elétron, chegou a admitir a divisibilidade da partícula atômica.
Para maiores informações pesquisar:
pt.wikipedia.org/wiki/Joseph_John_Thomson
O Átomo de Rutherford – Modelo do Sistema Solar
O físico Ernest Rutherford nasceu em Spring Grove no ano de 1871, na Nova Zelândia e faleceu na cidade de Cambridge no ano de 1937. Suas experiências serviram para determinar o modelo do sistema solar para o átomo. O sol seria o núcleo atômico carregado positivamente (prótons) e os planetas em suas órbitas seriam os elétrons de carga negativa circulando nos seus orbitais distantes do núcleo.
Nas suas atividades científicas pesquisou a radiatividade e descobriu os raios alfa, beta e gama.
Para maiores informações pesquisar:
pt.wikipedia.org/wiki/Ernest_Rutherford
Bhor as Órbitas Circulares dos Elétrons e as Camadas Eletrônicas
Niels Bhor nasceu na Dinamarca, (kǿbenhanvn) Copenhague no ano de 1885, e faleceu no ano de 1962 em Copenhague. Postulou que o núcleo do átomo era positivo devido aos prótons e que os elétrons de carga negativa, circulavam nas suas mesmas órbitas circulares em torno de um núcleo pequeno. Ele organizou os orbitais em 7 níveis, ou a formação de até 7 camadas em torno do núcleo atômico que receberam as letras K; L; M; N; O; P; Q.
Para maiores informações pesquisar:
www.portalsaofrancisco.com.br/…bohr/modelo-atomico-de-bohr-1.php
A Produção da Luz
A Luz é uma radiação eletromagnética em forma de onda com a faixa de freqüência de 7,5 x 10¹4 a 4,0 x 10¹4 hertz por segundo. Segunda lei de Bohr idealizou a produção da luz da seguinte forma O elétron em seu orbital em torno do núcleo recebe um quanta de energia, este salta de um orbital externo para um orbital interno absorve energia. Cessando o pulso de energia o elétron que está no orbital interno, volta para o seu orbital de origem emitindo um fóton (luz). Obs: o salto do elétron para a órbita interna pode ser de 1 ou mais orbitais, depende da energia aplicada sobre o elétron. Por exemplo: o elétron está no orbital 4, recebe energia vai para o orbital interno 2. Voltando para o seu orbital original 4, libera luz de cor correspondente a energia liberada (depende ainda do elemento químico usado para a cor da luz correspondente).
Diferentes Elementos Químicos, Cores Diferentes
O elemento químico argônio, pertencente ao grupo dos gases nobres, na forma de gás argônio, produz a luz azul esverdeada, é um exemplo de uma substância formado apenas por um elemento químico ou um único átomo individualmente, portanto esse gás não é formado por moléculas e sim por átomos individuais. O elemento químico neônio, pertencente aos gases nobres, se encontra naturalmente na forma de gás neônio, são átomos individuais que produzem a luz de neon de cor avermelhada.
O elemento químico sódio produz a cor amarela. Observa-se isso experimentalmente quando colocamos uma solução de cloreto de sódio para ser queimada numa chama, o que produz a cor respectiva.
O elemento químico potássio produz a luz de coloração violeta.
O elemento químico cálcio produz a luz de cor vermelho tijolo.
O elemento químico estrôncio, na forma de sal de estrôncio, ao ser queimado, produz a luz de cor vermelho-carmim. Está presente em fogos de artifício.
O elemento químico bário, quando queimado produz a luz de cor verde.
O elemento químico cobre na forma de sais de cobre ao ser queimado produz a luz de cor azul-esverdeada intensa.
o elemento químico césio produz a luz de cor azul-clara. Não esquecer que o césio é radioativo e emite partículas beta e principalmente a radiação gama é muito penetrante e contaminante nos tecidos biológicos.
O elemento químico Arsênio produz a cor da luz azul ao ser queimado.
O elemento químico magnésio ao ser queimado produz a cor da luz branco brilhante.
O elemento químico cálcio produz a cor laranja, é utilizado em fogos de artifício.
O elemento químico ferro utilizado em fogos de artifício produz a luz dourada.
Nos fogos de artifício as cores dependem do elemento químico utilizado.
Para maiores informações pesquisar:
www.portalsaofrancisco.com.br/…bohr/modelo-atomico-de-bohr-1.php
Sommerfeld e orbitais de trajetórias diferentes
Arnold Sommerfeld – físico nasceu em Konigsberg cidade da Prússia e faleceu em 1951. Em seus trabalhos científicos concluiu que os elétrons em um mesmo nível de camada podem fazer trajetórias diferentes nos seus orbitais, criando assim orbitais deferentes. Por exemplo: o orbital “s” tem a forma circular, o “p” tem a forma helicoidal e assim por diante.
Chadwick – Um Núcleo Com Nêutrons
Chadwick – físico britânico nasceu no ano de 1891 em Cheshire e faleceu em Cambridge no ano de 1974. Descobriu a partícula neutra do núcleo do átomo o nêutron. Juntamente com Rutherford produziu a desintegração de vários elementos químicos com partículas alfa. A partir dessas experiências percebeu que partículas positivas eram atraídas para o lado negativo o cátodo e as partículas negativas para o lado positivo o ânodo e outras partículas não eram atraídas por nenhuma dessas forças atrativas. Concluiu então que havia uma partícula neutra.
Para maiores informações pesquisar:
en.wikipedia.org/wiki/James_Chadwick
O Átomo Atual
O átomo atual é um intrincado de partículas e sub-partículas de cargas negativas e positivas em números iguais, ambas neutralizando a sua eletricidade. Igualmente aos modelos apresentados anteriormente, no seu núcleo estão os prótons formados pelas sub-partículas up e down e os nêutrons com suas duas sub-partículas up e down. Mais externamente encontram-se os elétrons.
Questionário
1) O formulador da teoria de que toda a matéria que existe é formada por átomos, que seriam partículas extremamente pequenas, esféricas, maciças, homogêneas, indivisíveis, indestrutíveis e sem carga elétrica, formando compostos a partir da combinação de dois ou mais átomos foi:
- a) Arnold Sommerfeld por volta de 1919.
b) Joseph John Thomson por volta do ano de1898.
c) Ernest Rutherford por volta do ano de 1914.
d) Niels Bhor por volta do ano de 1915.
e) John Dalton por volta do ano de 1803.
2) Com suas experiências realizadas com o tubo de raios catódicos, foi o descobridor da partícula de carga negativa do átomo, também foi o inventor do espectrógrafo de massa que possibilitava medir as massas dos átomos, elaborou a teoria de que o átomo deveria ser uma pequena esfera de massa positiva, com elétrons de carga negativa incrustados ou dispersos na massa dessa esfera formando a partícula, que poderia também sofrer divisão foi:
- a) Arnold Sommerfeld por volta do ano de 1919.
b) Joseph John Thomson por volta do ano de 1898.
c) Ernest Rutherford por volta do ano de 1914.
d) Niels Bhor por volta do ano de 1915.
e) John Dalton por volta do ano de 1803.
3) O pesquisador que determinou o átomo segundo o modelo do sistema solar, na qual o sol no centro seria a representação do núcleo do átomo carregado positivamente e o planetas em suas órbitas representariam os elétrons de carga negativa nos seus orbitais circulares distantes do núcleo separados por espaços vazios, foi:
- a) James Chadwick em 1932.
b) Hans Geiger em 1933.
c) Robert Oppenheimer em 1934.
d) Ernest Rutherford em 1919.
e) Frederick Soddy em 1914.
4) A produção da luz é o fenômeno que ocorre quando o átomo recebe energia elétrica, térmica, luminosa etc, e o seu elétron localizado no seu orbital sofre:
- a) um desarranjo exterior e salta para uma camada mais próxima do núcleo. Cessando essa energia sobre o átomo, o elétron se fixa nesse orbital interno liberando o fóton ou luz.
b) um rearranjo em seu exterior e salta para um nível externo ou mais distante do núcleo. Cessando essa energia sobre o elétron do orbital externo, este volta para o interno liberando o fóton ou luz.
c) exterior salta para o nível interno ou mais próximo do núcleo. Cessando essa energia sobre o átomo, o elétron do orbital interno, volta para o externo liberando o fóton ou luz de diferentes comprimentos de ondas produzindo as cores.
d) transição eletrônica do elétron, que do nível exterior salta para o nível interno ou mais próximo do núcleo. Cessando essa energia sobre o elétron do orbital interno, este volta para o externo liberando os raios de luz infravermelha.
e) transição eletrônica, nesse caso, o elétron do nível exterior salta para um nível interno ou mais próximo do núcleo. Cessando esse energia sobre o átomo, o elétron do orbital interno volta para o externo liberando o fóton ou luz.
5) Nos seus experimentos Rutherford determinou a existência de uma região que contém carga elétrica positiva.
- a) Essa região está no centro do átomo onde forma o seu núcleo onde há grandes espaços vazios, aí estão localizadas as partículas de carga positiva do átomo.
b) Essa região está no centro do átomo onde forma o seu núcleo que é denso e pequeno, aí estão localizadas as partículas de carga positiva do átomo.
c) Essa região está na eletrosfera do átomo, onde forma o seu núcleo que é denso e pequeno, aí estão localizadas as partículas de carga positiva e negativa átomo.
d) Essa região está no centro do átomo onde forma o seu núcleo que é vazio e pequeno, aí estão localizadas as partículas de carga negativa do átomo.
e) Essa região está no centro do átomo onde forma ao sua eletrosfera que é densa e pequena, aí estão localizadas as partículas de carga positiva do átomo.
Aula 6
Estrutura do Átomo
Cálculo das partículas atômicas
O cálculo das partículas atômicas é utilizado para determinar o número de prótons, nêutrons e elétrons de um átomo.
Representação de um átomo e suas partículas
A estrutura de um átomo é composta basicamente por núcleo, níveis, subníveis, orbitais e partículas atômicas. As partículas atômicas são os prótons, nêutrons e elétrons. Os prótons e nêutrons estão localizados no interior do núcleo, e os elétrons, nos orbitais.
Para realizar o cálculo das partículas atômicas, é fundamental que conheçamos algumas características do átomo:
É representado pela letra Z, sempre maiúscula, e indica:
- A quantidade de prótons (p) no interior do núcleo;
- A quantidade de elétrons (e) no interior dos orbitais.
Assim, o número atômico é igual ao número de prótons e elétrons:
Z = p = e
O número atômico é posicionado sempre à esquerda, subscrito, na sigla do átomo do elemento químico, como na representação abaixo:
ZX
É representado pela letra A, sempre maiúscula, e indica a soma do número de prótons (p) com o número de nêutrons (n) presentes no núcleo do átomo:
A = p + n
O número de massa é posicionado sempre à esquerda ou à direita, sobrescrito, na sigla do átomo do elemento químico, como na representação abaixo:
AX ou XA
Agora veja alguns exemplos:
- c) Exemplos de cálculo do número de partículas
1º Exemplo: Cálculo das partículas do átomo Sódio (11Na23)
- Número atômico (subscrito à esquerda): 11
Como o número atômico é 11, logo, temos no átomo de Sódio:
- 11 prótons
- 11 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (11) e o número de massa (sobrescrito à direita, 23). Para isso, utilize a fórmula abaixo:
A = p + n
23 = 11 + n
23 – 11 = n
N = 12
2º Exemplo: Cálculo das partículas do átomo Estanho (50Sn119)
- Número atômico (subscrito à esquerda): 50
Como o número atômico é 50, logo, temos no átomo de Estanho:
- 50 prótons
- 50 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (50) e o número de massa (sobrescrito à direita, 119). Para isso, utilize a fórmula abaixo:
A = p + n
119 = 50 + n
119 – 50 = n
N = 69
Exemplo 3: Cálculo das partículas do átomo de Urânio (92U238)
- Número atômico (subscrito à esquerda): 92
Como o número atômico é 92, logo, temos no átomo de Urânio:
- 92 prótons
- 92 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (92) e o número de massa (sobrescrito à direita, 238). Para isso, utilize a fórmula abaixo:
A = p + n
238 = 92 + n
238 – 92 = n
N = 146
Cada elemento químico é definido por meio de seu número atômico.
- O número atômico (Z) indica a quantidade de prótons (p) do átomo do elemento.
Por exemplo: Magnésio (Mg) Z=12 (Z=p)
2. O número de massa atômica (A) é a soma das massas unitárias dos prótons (p) com a dos nêutrons (n).
Por exemplo: Magnésio (Mg) A=24 (A=p+n)
Obs.: como os átomos são eletricamente neutros, o número de prótons é igual ao número de elétrons. Já nos íons a uma preponderância de um deles: se o número de prótons é maior que o de elétrons, o íon é positivo; caso contrário, é negativo.
p=número de prótons e=número de elétrons n=número de nêutrons
Existem características que reúnem átomos de um ou mais elementos, formando grupos. São eles:
Os prótons e nêutrons compõem o núcleo do átomo. Os elétrons, por sua vez, distribuem-se na eletrosfera em níveis e subníveis de energia. São 7 níveis, e cada um deles pode ter de 1 a 4 subníveis.
Aula 7
Histórico da tabela periódica
Organizar os elementos químicos em grupos com a finalidade de facilitar o estudo das substâncias derivadas destes tem sido tarefa árdua, busca esta realizada desde o século passado.
As primeiras tentativas, datam de 1829, através de Döbereiner e as mais recentes datam da década passada. Döbereiner propôs organizar os elementos em grupos de três, tal que o peso atômico do elemento central fosse a média aritmética dos outros dois. Tal tabela ficou conhecida como “Tríades de Döbereiner “.
Em 1863, Chancourtois imaginou um cilindro cuja superfície foi dividida em 16 partes iguais. Os elementos ordenados em ordem crescente de pesos atômicos, ficariam de tal maneira que, visualizados verticalmente, os elementos de uma mesma coluna apresentariam propriedades semelhantes. Tal tabela ficou conhecida como “parafuso telúrico”
Em 1865, Newland observou que colocando os elementos em ordem crescente de pesos atômicos, havia repetição nas propriedades em intervalos de 8 em 8. Sendo assim, ele definiu a “lei das oitavas”.
Inúmeras outras tabelas surgiram até que em 1872, Mendeleev publicou uma tabela que serviu de base para a atualmente em uso. Além disso, Mendeleev foi capaz de prever a existência de elementos desconhecidos e prever as propriedades das substâncias simples deles derivados.
A grande mudança ocorrida nas tabelas deste século, comparada com as do século passado, foi a do referencial: em vez de ordenar os elementos pelos pesos atômicos, passou-se a usar os números atômicos.
Em 1988, a IUPAC, após consulta a várias Sociedades Científicas, divulgou o modelo que deverá ser adotado gradativamente no mundo inteiro. Tal modelo, numera os grupos de 1 a 18.
Famílias e períodos
Família ou grupo é o conjunto de elementos que ocupam a mesma coluna vertical da tabela periódica. Assim, temos a família 1 ou família “1 A” , formada pelos elementos H, Li, Na, K, Rb, Cs e Fr. Elementos pertencentes a uma mesma família apresentam distribuição semelhante, isto é, se a distribuição de um terminar em “ s1”, todos os demais também terminarão em “1s1”
Período é o conjunto de elementos que ocupam a mesma coluna horizontal da tabela periódica e corresponde à quantidade de níveis de energia que possuem. Desse modo, o primeiro período é formado apenas pelo H e He e possuem apenas um nível energético (1s). O segundo pelos elementos Li, Be, B, C, N, O, F e Ne e possuem 2 níveis energéticos (1s, 2s e/ou 2p).
Elementos representativos
São aqueles cuja distribuição eletrônica apresenta os elétrons mais energéticos na última camada, isto é, a distribuição termina no subnível “s” ou “p”.
São os elementos das famílias 1, 2, 13, 14, ,15, 16, 17 e 18.
Elementos da família 1, terminam em “s1”
Elementos da família 2, terminam em “s2”
Elementos da família 13 terminam em “p1”
Elementos da família 14 terminam em “p2”
Elementos da família 15 terminam em “p3”
Elementos da família 16 terminam em “p4”
Elementos da família 17 terminam em “p5”
Elementos da família 18 ou 0 terminam em “p6”
Elementos de transição
São aqueles cuja distribuição eletrônica apresenta o elétron mais energético na penúltima e na última camada, isto é, a distribuição eletrônica termina no subnível “d” ou “f”.
São elementos das famílias 3 ao 12.
Os elementos de transição podem ser:
- Transição simples: o elétron de diferenciação está no subnível “d” da penúltima camada.
- Transição interna: o elétron de diferenciação está no subnível “f” da penúltima camada. São eles:
b1) Lantanídios: são os elementos de transição interna do sexto período da família 3.
b2) Actinídios: são os elementos de transição interna do sétimo período da família 3..
Nomes coletivos
A IUPAC, recomenda o uso dos seguintes nomes coletivos:
METAIS ALCALINOS: são os elementos da família 1 A ou 1 , exceto o hidrogênio : Li, Na, K, Rb, Cs e Fr.
METAIS ALCALINOS TERROSOS: são os elementos da família 2 A ou 2, exceto o berílio e o magnésio: (Ca, Sr, Ba e Ra)
CALCOGÊNIOS : são os elementos da família 6 A ou 16 : O, S, Se, Te, Po
HALOGÊNIOS : são os elementos da família 7 A ou 17: F, Cl, Br, I, At
GASES NOBRES : são os elementos da família 8 A ou 18: He, Ne, Ar, Kr, Xe, Rn
Propriedades periódicas
São aquelas que atingem valores máximo e mínimo em intervalos mais ou menos regulares, quando estas são colocadas em um gráfico em função do número atômico.
Raio atômico: é a metade da distância entre dois núcleos vizinhos. Na tabela periódica, o raio atômico cresce de cima para baixo e da direita para a esquerda. Portanto o He é o que apresenta menos raio, enquanto o Fr apresenta o maior.
Potencial de ionização ou energia de ionização: é a energia necessária para arrancar um elétron de um átomo isolado, no estado gasoso. Na tabela periódica, o potencial de ionização cresce de baixo para cima e da esquerda para a direita. O elemento que apresenta maior PI é o He e o que apresenta menor P.I é o Fr.
Afinidade eletrônica ou eletroafinidade: é a energia liberada quando um elétron é adicionado a um átomo neutro no estado gasoso. Na tabela periódica, a afinidade eletrônica cresce de baixo para cima e da esquerda para direita, excetuando-se os gases nobres. O F é o que apresenta maior A . E e o Fr é o que apresenta menor A . E.
Eletronegatividade: é a tendência que um átomo apresenta em atrair para si os elétrons de uma ligação covalente. Também determina a polaridade das moléculas. Na tabela periódica, cresce de baixo para cima e da esquerda para direita, excetuando-se os gases nobres. O F é que apresenta maior eletronegatividade e o Fr é o que apresenta menor valor. Na escala de Pauling, temos: F = 4,0 ; O = 3,5 ; N = 3,0 ; Cl = 3,0 ; C = 2,5; S = 2,5 ; H = 2,1 entre outros.
Eletropositividade ou caráter metálico: É a capacidade de um átomo perder elétrons, originando cátions. Os metais apresentam elevadas eletropositividades, pois uma de suas características é a grande capacidade de perder elétrons (doadores de elétrons). Entre o tamanho do átomo e sua eletropositividade, há uma relação genérica, uma vez que quanto maior o tamanho do átomo, menor a atração núcleo-elétron e, portanto, maior a sua facilidade em doar elétrons. Esta propriedade não está definida para os gases nobres.
Volume atômico: é o volume ocupado por 1 mol de átomos do elemento no estado sólido. Trata-se do volume de um conjunto de átomos, e não de um único átomo. Portanto depende do tipo de empacotamento existente. Na tabela periódica, o VA cresce de cima para baixo e do centro para as extremidades. Portanto os maiores volumes atômicos encontram-se nos cantos inferiores.
Densidade absoluta ou massa específica: É a relação entre a massa e seu volume. Na tabela periódica, cresce de cima para baixo e das extremidades para o centro. Nos períodos a densidade varia no sentido oposto ao da variação dos volumes atômicos pois, quanto menor o volume, maior deverá ser a densidade, segundo a fórmula d=m/V. Os elementos de maior densidade encontram-se na região central inferior da tabela como Os ( 22,5 g/mL) e o Ir ( 22,4 g/mL)
Pontos de fusão e ebulição: estas propriedades mudam de forma variada na tabela periódica. E geral, crescem das extremidades para o centro. Na região esquerda, crescem de baixo para cima e na região direita crescem de cima para baixo. Os elementos com maior ponto de fusão e ebulição são o C ( PF = 3700 °C e PE = 4800 °C) e W ( PF = 3380 °C e PE = 5927 °C).
Propriedades aperiódicas
Os valores somente crescem ou decrescem à medida que aumenta o número atômico.
Massa atômica: É a massa do átomo medida em unidades de massa atômica (u). Com o aumento do número atômico, a massa atômica sempre aumenta.
Calor específico: É a quantidade de calor necessária para elevar de 1°C a temperatura de 1g do elemento. Com o aumento do número atômico o calor específico do elemento no estado sólido sempre diminui.
Exercícios conceituais
- (Ufrs 2006) A observação da tabela periódica permite concluir que, dos elementos a seguir, o mais denso é o:
- a) Fr. b) Po. c) Hg. d) Pb. e) Os.
- (cftmg 2005) O subnível mais energético do átomo de um elemento é o 5p3, portanto, o seu número atômico e sua posição na tabela periódica serão, respectivamente:
- a) 15, 3° período e coluna 5 A.
- b) 51, 5° período e coluna 5 A.
- c) 51, 3° período e coluna 3 A.
- d) 49, 5° período e coluna 3 A.
- Qual alternativa apresenta somente elementos de transição?
- a) F e S b) B e E c) H e U d) G e I e) H e E
- Quais são as letras dos elementos que representam a família dos alcalinos terrosos?
- Qual letra representa o elemento que possui 3 elétrons na camada de valência
- Qual letra representa o elemento mais eletronegativo da tabela?
- Qual letra representa o elemento de maior ponto de fusão e ebulição?
- Qual a letra que representa o elemento de maior raio atômico, considerando o quarto período da tabela?
- Da família dos calcogênios, qual apresenta o maior potencial de ionização?
Obs.: As massas atômicas na tabela periódica são calculadas por uma média ponderada das massas dos isótopos de cada elemento encontrados na natureza.
Aula 8
Distribuição Eletrônica
Camadas Eletrônicas ou Níveis de Energia
A coroa ou eletrosfera está dividida em 7 camadas designadas por K, L, M, N, O, P, Q ou pelos números: n = 1, 2, 3, 4, 5, 6, 7.
O número de camada é chamado número quântico principal (n).
Número máximo de elétrons em cada nível de energia:
1. Teórico:
Equação de Rydberg: x = 2n2
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 50 | 72 | 98 |
- Experimental:
O elemento de número atômico 112 apresenta o seguinte número de elétrons nas camadas energéticas:
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 32 | 18 | 2 |
Camada de valência é a camada mais externa do átomo e pode contar no máximo 8 elétrons
Subcamadas ou Subníveis de Energia
Uma camada de número n será subdividida em n subníveis:
s, p, d, f, g, h, i…
Nos átomos dos elementos conhecidos, os subníveis teóricos g, h, i… estão vazios.
Número máximo de elétrons em cada subnível experimental:
| s | p | d | f |
| 2 | 6 | 10 | 14 |
Distribuição dos elétrons nos subníveis (configuração eletrônica)
Os subníveis são preenchidos em ordem crescente de energia (ordem energética). Linus Pauling descobriu que a energia dos subníveis cresce na ordem:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
É nessa ordem que os subníveis são preenchidos. Para obter essa ordem basta seguir as diagonais no Diagrama de Pauling abaixo:
Seqüência de preenchimento de orbitais
Deve-se observar a ordem energética dos subníveis de energia, que infelizmente não é igual à ordem geométrica. Isso porque subníveis de níveis superiores podem ter menor energia total do que subníveis inferiores. A energia de um subnível é proporcional à soma (n + l) de seus respectivos números quânticos principal (n) e secundário (l).
O número quântico azimutal ou secundário, representado pela letra l, especifica a subcamada e, assim, a forma do orbital. Pode assumir os valores 0, 1, 2 e 3, correspondentes às subcamadas s, p, d, f.
Método analítico para ordenação dos subníveis:
Exemplos
1)
3d 4s
n = 3 n = 4
l = 2 l = 0
n + l = 5 n + l = 4
3d é mais energético que 4s
2)
3d 4p
n = 3 n = 4
l = 2 l = 1
n + l = 5 n + l = 5
Quando os subníveis apresentarem a mesma soma, o mais afastado ou de maior nível energético terá maior energia.
Ordem geométrica é a ordenação crescente de níveis energéticos.
Exemplo: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p…
Camada de Valência é o último nível de uma distribuição eletrônica, normalmente os elétrons pertencentes à camada de valência, são os que participam de alguma ligação química.
Exemplo: Arsênio (As): Z = 33
– Ordem energética (ordem de preenchimento): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
– Ordem geométrica (ordem de camada): 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Camadas Energéticas: K = 2; L = 8; M = 18; N = 5
A camada de valência do As é a camada N, pois é o último nível que contém elétrons.
Distribuição Eletrônica em Íons
Átomo: nº de prótons = nº de elétrons
Íon: nº de prótons (p) ≠ nº de elétrons
Íon positivo (cátion): nº de p > nº de elétrons
Íon negativo (ânion): nº de p < nº de elétrons
Distribuição Eletrônica em Cátion
Retirar os elétrons mais externos do átomo correspondente. Exemplo:
Ferro (Fe) Z = 26 → 1s2 2s2 2p6 3s2 3p6 4s2 3d6 (estado fundamental = neutro)
Fe2+ → 1s2 2s2 2p6 3s2 3p6 3d6 (estado iônico)
Distribuição Eletrônica em Ânion
Colocar os elétrons no subnível incompleto. Exemplo:
Oxigênio (O) Z = 8 → 1s2 2s2 2p4 (estado fundamental = neutro)
O2- → 1s2 2s2 2p6
Os números átomos.
Existem quatro números quânticos: quânticos descrevem a posição (e a energia) dos elétrons nos
Número quântico principal: indica o nível (camada) de energia.
Número quântico secundário ou azimutal: indica o sub-nível de energia.
Número quântico magnético: indica o orbital.
Número quântico de spin: indica a orientação do elétron no orbital.
Dois elétrons nunca terão os quatro números quânticos iguais, pois mesmo que estejam no mesmo nível, no mesmo sub-nível e no mesmo orbital, terão spins opostos. Assim, qualquer par de elétrons pode ter até três números quânticos iguais.
- Número quântico principal, n
O número quântico principal terá como valores 1, 2, 3, 4…de acordo com o nível eletrônico que o elétron se encontra.
- Número quântico azimutal, l
O número quântico azimutal, informa-nos sobre a forma dos orbitais (s, p, d, f). Para um dado valor de n, l pode ter como valores possíveis os números inteiros de 0 a (n − 1). Para os sub-níveis s, p d, f, temos:
s = 0, p = 1 , d = 2 , f = 3
- Número quântico magnético, ml
O número quântico magnético especifica a orientação permitida para uma nuvem eletrônica no espaço, sendo que o número de orientações permitidas está diretamente relacionado à forma da nuvem (designada pelo valor de l). Dessa forma, este número quântico pode assumir valores inteiros de -l, passando por zero, até +l. Para os sub-níveis s, p d, f, temos:
| s | 0 | ||||||
| p | -1 | 0 | +1 | ||||
| d | -2 | -1 | 0 | +1 | +2 | ||
| f | -3 | -2 | -1 | 0 | +1 | +2 | +3 |
- Número quântico de spin, ms
O número quântico de spin indica a orientação do elétron ao redor do seu próprio eixo. Como existem apenas dois sentidos possíveis, este número quântico assume apenas os valores -1/2 e +1/2.
- Exemplos: Quais os nºs quânticos do último elétron (elétron diferencial, verificador) de cada átomo abaixo?
Al = 1s22s22p63s23p1
Logo os nºs quânticos são referentes ao elétron de 3p1:
n = 3 (terceiro nível)
l = 1 (sub-nível p)
ml = -1 (primeiro orbital p)
ms = -1/2 (rotação)
Fe = 1s22s22p63s23p64s23d6
Logo os nºs quânticos são referentes ao elétron de 3d6:
n = 3 (terceiro nível)
l = 2 (sub-nível d)
ml = -2 (primeiro orbital d)
ms = +1/2 (rotação)
Aula9
Ligações químicas
É impossível se pensar em átomos como os constituintes básicos da matéria sem se pensar em ligações químicas. Afinal, como podemos explicar que porções tão limitadas de matéria, quanto os átomos, possam formar os corpos com que nos deparamos no mundo macroscópico do dia-a-dia. Também é impossível se falar em ligações químicas sem falarmos em elétrons. Afinal, se átomos vão se unir uns aos outros para originar corpos maiores, nada mais sensato do que pensar que estes átomos entrarão em contato entre si. Quando dois átomos entram em contato, o fazem a través das fronteiras das suas eletrosferas, ou seja, de suas últimas camadas. Isso faz pensar que a última camada de um átomo é a que determina as condições de formação das ligações químicas.
Em 1868, Kekulé e Couper, propuseram a utilização do termo valência para explicar o poder de combinação de um átomo com outros. A valência de um dado elemento é que determina as fórmulas possíveis ou não de compostos formados por ele.
A primeira situação seria entender por que dois ou mais átomos se ligam, formando uma substância simples ou composta. Como, na natureza, os únicos átomos que podem ser encontrados no estado isolado (moléculas monoatômicas) são os gases nobres, logo se pensou que os demais átomos se ligariam entre si tentando alcançar a configuração eletrônica do gás nobre mais próximo deles na tabela periódica. Todos os gases nobres, com exceção do He, possuem 8 elétrons.
Esta maneira de pensar a ligação entre os átomos passou a ser conhecida por Teoria do octeto, e foi proposta por Kossel e Lewis no início do século XX. Baseado nessa idéia, a valência de um átomo passou a ser vista como a quantidade de elétrons que um átomo deveria receber, perder ou compartilhar para tornar sua última camada (camada de valência) igual a do gás nobre de número atômico mais próximo.
As ligações químicas podem ser classificadas em três categorias:
– Iônica – Covalente normal e dativa – Metálica
Ligação Iônica
Como o próprio nome já diz, a ligação iônica ocorre com a formação de íons. A atração entre os átomos que formam o composto é de origem eletrostática. Sempre um dos átomos perde elétrons, enquanto o outro recebe. O átomo mais eletronegativo arranca os elétrons do de menor eletronegatividade. Ocorre entre metais e não metais e entre metais e hidrogênio.
Átomo com facilidade para liberar os elétrons da última camada: metal
Átomo com facilidade de adicionar elétrons à sua última camada: não metal
A ligação iônica ocorre entre metais e não metais e entre metais e hidrogênio. Num composto iônico, a quantidade de cargas negativas e positivas é igual.
A ligação entre o sódio (11Na) e o cloro (17Cl) é um exemplo característico de ligação iônica. Observe a distribuição dos elétrons em camadas para os dois elementos:
Na 2 – 8 – 1 Cl 2 – 8 – 7
Para o cloro interessa adicionar um elétron à sua última camada, completando a quantidade de oito elétrons nela. Ao sódio interessa perder o elétron de sua camada M, assim a anterior passará a ser a última, já possuindo a quantidade necessária de elétrons. Na representação da ligação, utilizamos somente os elétrons da última camada de cada átomo. A seta indica quem cede e quem recebe o elétron. Cada elétron cedido deve ser simbolizado por uma seta. Esta representação é conhecida por fórmula eletrônica ou de Lewis.
O sódio possuía inicialmente 11 prótons e 11 elétrons. Após a ligação, a quantidade de prótons não se altera e a de elétrons passa a ser 10. O cloro que inicialmente possuía 17 prótons e 17 elétrons, tem sua quantidade de elétrons aumentada de uma unidade após a ligação. Com isso o sódio se torna um íon de carga 1+ e o cloro 1-. A força que mantém os dois átomos unidos é de atração elétrica, ou seja, uma ligação muito forte. Como foram utilizados um átomo de cada tipo, a fórmula do composto será NaCl.
De maneira análoga podemos observar a ligação entre o flúor (9F) e o alumínio (13Al). O alumínio perde os três elétrons de sua última camada, pois a penúltima já possui os oito elétrons necessários. Como o átomo de flúor possui 7 elétrons em sua última camada, precisa de apenas mais um elétron. São necessários três átomos de flúor para acomodar os três elétrons cedidos pelo alumínio.
De maneira análoga ao exemplo anterior, ocorre a formação de íons positivo e negativo devido a quebra do equilíbrio entre as quantidades de prótons e elétrons nos átomos. O alumínio passa a ser um íon de carga 3+ e o fluor 1-. A fórmula do composto será AlF3.
Ligação covalente simples
É o tipo de ligação que ocorre quando os dois átomos precisam adicionar elétrons em suas últimas camadas. Somente o compartilhamento é que pode assegurar que que estes átomos atinjam a quantidade de elétrons necessária em suas últimas camadas. Cada um dos átomos envolvidos entra com um elétron para a formação de um par compartilhado, que a partir da formação passará a pertencer a ambos os átomos. Ocorre entre não metais e não metais, não metais e hidrogênio e entre hidrogênio e hidrogênio.
O hidrogênio possui somente uma camada contendo um único elétron, compartilhando 1 elétron, atinge a quantidade necessária para a camada K, que é de dois elétrons. Os elétrons compartilhados passam a ser contados para as eletrosferas dos dois átomos participantes da ligação.
Na molécula de nitrogênio ocorrem três ligações covalentes entre os dois átomos.
7N 2 – 5
Estas três ligações garantem que os dois átomos de nitrogênio atinjam a quantidade de oito elétrons nas suas últimas camadas. A ligação covalente entre dois átomos iguais é dita apolar, pois nela os elétrons são compartilhados de maneira igual, nenhum dos átomos tem mais força que o outro para atrair o elétron para si.
A molécula de CO2 é formada por dois átomos de oxigênio e um de carbono unidos através de ligações covalentes.
6C 2 – 4 8O 2 – 6
O átomo de carbono compartilha 4 elétrons e cada átomo de carbono 2, garantindo assim que ambos atinjam os oito elétrons nas últimas camadas.
Como a ligação é entre átomos diferentes e com diferentes eletronegatividades, a ligação é dita polar pois o átomo de oxigênio atrai para si mais fortemente os elétrons compartilhados.
Além da fórmula eletrônica, os compostos covalentes podem ser representados pela fórmula estrutural, onde cada par compartilhado é representado por um traço.
Ex.: H – H, O = C = O.
Uma ligação covalente unindo dois átomos é dita simples. O conjunto de duas ligações unindo dois átomos é dito dupla ligação. O conjunto de rês ligações unindo dois átomos é dito tripla ligação.
Ligação covalente dativa ou coordenada
A existência de algumas moléculas não pode ser explicada simplesmente através da ligação covalente simples. Para estes casos foi formulada a teoria da ligação covalente coordenada. Neste tipo de ligação, um dos átomos que já estiver com última camada completa entra com os dois elétrons do par compartilhado.
Este par de elétrons apresenta as mesmas características do da ligação covalente simples, a única diferença é a origem dos elétrons, que é somente um dos átomos participantes da ligação. Os elétrons do par passam a pertencer a ambos os átomos participantes. A ligação covalente coordenada é representada por uma seta que se origina no átomo doador e termina no átomo receptor.
Dadas as distribuições eletrônicas em camadas para os átomos de 16S e 8O.
S 2 – 8 – 6 O 2 – 6
Compartilhando dois elétrons através de ligações covalentes simples, ambos os átomos atingem os oito elétrons na última camada.
No entanto, esta molécula ainda pode incorporar ainda um ou dois átomos de oxigênio. Tal fato só pode ser explicado se o enxofre utilizar um ou dois pares de elétrons não envolvidos em ligações para formar um ou dois pares dativos com o oxigênio.
Outra molécula que não pode ser explicada somente com a ligação covalente simples é a de CO2. O interessante desta molécula é que a ligação covalente dativa ocorre do átomo mais eletronegativo (O) para o menos eletronegativo (C).
Ligação metálica
É o tipo de ligação que ocorre entre os átomos de metais. Os átomos dos elementos metálicos apresentam forte tendência a doarem seus elétrons de última camada. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada. Forma-se então uma rede ordenada de íons positivos mergulhada num mar de elétrons em movimento aleatório. Se aplicarmos um campo elétrico a um metal, orientamos o movimento dos elétrons numa direção preferencial, ou seja, geramos uma corrente elétrica.
A Escala de Pauling foi definida por Linus Pauling e tem a função de medir a eletronegatividade dos elementos químicos.
A eletronegatividade está relacionada à atratividade dos átomos e moléculas, ou seja, ao potencialque estes possuem de atrair elétrons.
Na tabela periódica, a eletronegatividade aumenta da esquerda para a direita e de baixo para cima, ou seja, conforme os períodos aumentam, maior é o número de camadas da eletrosfera dos elementos e, portanto, maior o seu raio, o que influencia diretamente na sua eletronegatividade, já que haverá uma aproximação menor entre os elétrons a serem compartilhados e o núcleo do átomo, que exerce o ponto de atração.
Assim, o elemento mais eletronegativo é o flúor. A ordem de polaridade é, portanto:
F > O > N > Cl > Br > I > S > C > P > H
A eletronegatividade influencia na ligação entre os átomos, já que haverá a possibilidade de maior ou menor atração.
O átomo com mais eletronegatividade atrai para si mais elétrons. A diferença de eletronegatividade entre os elementos determina se a ligação será polar ou apolar. Se a diferença de eletronegatividade for igual a zero, a ligação será apolar, do contrário a ligação será polar.
A polaridade das ligações químicas explica fatores como o fato de água e óleo não se misturarem. Em razão da polaridade das moléculas da água, uma das ligações mais fortes conhecidas, o óleo permanece em sua superfície, já que, para que pudesse imiscuir-se na água seria necessário o fornecimento de uma quantidade razoável de energia para “quebrar” suas moléculas ou, ainda, que sua ligação fosse, também, polar, o que não ocorre, já que as ligações químicas de óleos e gorduras são apolares. Além disso, os hidrocarbonetos, moléculas formadas por Hidrogênio e Carbono, muitos deles derivados do petróleo, são, também, apolares.
Uma substância polar pode imiscuir-se numa substância polar, da mesma forma que as substâncias apolares podem imiscuir-se entre si.
A eletronegatividade está, portanto, relacionada à força para rompimento de ligações químicas das moléculas.
Numa ligação química, o átomo com maior eletronegatividade, ao atrair os elétrons, fica com a carga negativa. Por outro lado, os átomos com menor eletronegatividade perdem elétrons e, em razão disso, adquirem uma carga positiva.
Além do raio atômico, outro fator que influencia a eletronegatividade é o número de elétrons que o átomo possui em sua última camada. Quanto maior o número de elétrons, mais o átomo deseja atrair elétrons externos para alcançar a estabilidade (8 elétrons na última camada). Porém, tal fator não deve ser considerado como único critério, já que demonstrações práticas sugerem que o Cloro, que possui 7 elétrons na camada de valência, é menos eletronegativo que o Oxigênio, que possui 6 elétrons na camada de valência.
Aula10
Funções inorgânicas
Na Química Inorgânica são classificadas 4 funções:
- Ácidos 2. Bases 3. Sais 4. Óxidos
Ácidos são todas as substancias que, em meio aquoso, produzem somente íons positivos (cátions) H+
Exemplos: HCl (ácido clorídrico) e H2SO4 (ácido sulfúrico)
Um primeiro critério para classificação dos ácido é conforme possuam ou não oxigênio (O) em sua composição. Segundo este critério, temos os Hidrácidos e os Oxiácidos.
Nomenclatura dos Hidrácidos
Nome do elemento + Sufixo ídrico
Nomenclatura de alguns Oxiácidos:
Bases
Obs.: pode-se resumir a nomenclatura como Hidróxido de …(nome do cátion).
Classificação das bases segundo sua força:
Sais
Nomenclatura dos sais:
Nome do sal = sufixo do sal + nome do íon positivo (cátion)
O sufixo do sal provém do sufixo do ácido de origem:
Óxidos
São compostos binários (dois elementos) que contém oxigênio que é o elemento mais eletronegativo.
Nomenclatura dos óxidos:
Nome do óxido = prefixo de quantidade de oxigênios + óxido de + prefixo da quantidade do outro elemento + nome do outro elemento.
Para os óxidos de metais de nox fixo (com o oxigênio com nox 2) a nomenclatura é:
nome do óxido = óxido de + nome do outro elemento.
– Para óxidos de elementos de nox variável (com o oxigênio com nox 2):
Nome do óxido = óxido de + nome do outro elemento + nox do elemento (em algarismos romanos).
Nome do óxido = peróxido de + nome do outro elemento
Caracterização dos óxidos:
Exercícios:
- (FUC-MT) O óxido de magnésio (Mg0) precisa ser substituído por um óxido que apresenta propriedades químicas semelhantes e mesma proporção de átomos. Entre os óxidos a seguir, qual você escolheria?
- (Fuvest-SP)Cal viva é óxido de cálcio (CaO).
- Escreva a equação da reação da cal viva com a água.
- b. Por que, na agricultura, a cal viva é acionada ao solo?
- (ENEM)
I – monumento Itamarati – Brasília (mármore).
II – esculturas do Aleijadinho MG (pedra sabão, contém carbonato de cálcio).
III – grades de ferro ou alumínio de edifícios.
A ação da chuva ácida pode acontecer em:
- I, apenas.
- I e II, apenas.
- I e III, apenas.
- II e III, apenas.
- I, II e III.
- (Fuvest-SP)Quando aplicada em ferimentos, a água oxigenada parece “ferver”. Por quê?
- Escreva a equação que representa a reação química envolvida.
- (Fuvest-SP)Na respiração animal, o ar expirado pode ser distinguido do ar inspirado borbulhando-se separadamente em soluções aquosas de hidróxido de bário.
- Qual o critério usado para fazer essa diferenciação?
- Represente o fato observado por meio de uma equação química.



