Cálculo das partículas atômicas
O cálculo das partículas atômicas é utilizado para determinar o número de prótons, nêutrons e elétrons de um átomo.
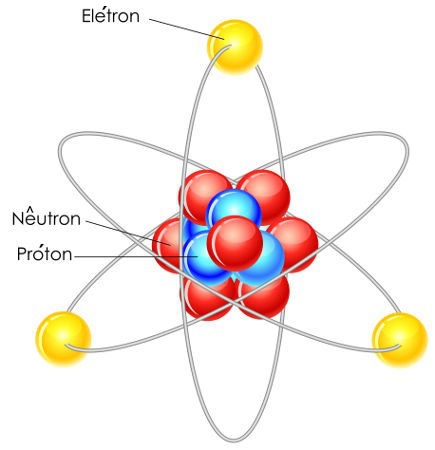
Representação de um átomo e suas partículas
A estrutura de um átomo é composta basicamente por núcleo, níveis, subníveis, orbitais e partículas atômicas. As partículas atômicas são os prótons, nêutrons e elétrons. Os prótons e nêutrons estão localizados no interior do núcleo, e os elétrons, nos orbitais.
Para realizar o cálculo das partículas atômicas, é fundamental que conheçamos algumas características do átomo:
É representado pela letra Z, sempre maiúscula, e indica:
- A quantidade de prótons (p) no interior do núcleo;
- A quantidade de elétrons (e) no interior dos orbitais.
Assim, o número atômico é igual ao número de prótons e elétrons:
Z = p = e
O número atômico é posicionado sempre à esquerda, subscrito, na sigla do átomo do elemento químico, como na representação abaixo:
ZX
É representado pela letra A, sempre maiúscula, e indica a soma do número de prótons (p) com o número de nêutrons (n) presentes no núcleo do átomo:
A = p + n
O número de massa é posicionado sempre à esquerda ou à direita, sobrescrito, na sigla do átomo do elemento químico, como na representação abaixo:
AX ou XA
Agora veja alguns exemplos:
c) Exemplos de cálculo do número de partículas
1º Exemplo: Cálculo das partículas do átomo Sódio (11Na23)
- Número atômico (subscrito à esquerda): 11
Como o número atômico é 11, logo, temos no átomo de Sódio:
- 11 prótons
- 11 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (11) e o número de massa (sobrescrito à direita, 23). Para isso, utilize a fórmula abaixo:
A = p + n
23 = 11 + n
23 – 11 = n
N = 12
2º Exemplo: Cálculo das partículas do átomo Estanho (50Sn119)
- Número atômico (subscrito à esquerda): 50
Como o número atômico é 50, logo, temos no átomo de Estanho:
- 50 prótons
- 50 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (50) e o número de massa (sobrescrito à direita, 119). Para isso, utilize a fórmula abaixo:
A = p + n
119 = 50 + n
119 – 50 = n
N = 69
Exemplo 3: Cálculo das partículas do átomo de Urânio (92U238)
- Número atômico (subscrito à esquerda): 92
Como o número atômico é 92, logo, temos no átomo de Urânio:
- 92 prótons
- 92 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (92) e o número de massa (sobrescrito à direita, 238). Para isso, utilize a fórmula abaixo:
A = p + n
238 = 92 + n
238 – 92 = n
N = 146
Cada elemento químico é definido por meio de seu número atômico.
1. O número atômico (Z) indica a quantidade de prótons (p) do átomo do elemento.
Por exemplo: Magnésio (Mg) Z=12 (Z=p)
2. O número de massa atômica (A) é a soma das massas unitárias dos prótons (p) com a dos nêutrons (n).
Por exemplo: Magnésio (Mg) A=24 (A=p+n)
Obs.: como os átomos são eletricamente neutros, o número de prótons é igual ao número de elétrons. Já nos íons a uma preponderância de um deles: se o número de prótons é maior que o de elétrons, o íon é positivo; caso contrário, é negativo.

p=número de prótons e=número de elétrons n=número de nêutrons
Existem características que reúnem átomos de um ou mais elementos, formando grupos. São eles:

Os prótons e nêutrons compõem o núcleo do átomo. Os elétrons, por sua vez, distribuem-se na eletrosfera em níveis e subníveis de energia. São 7 níveis, e cada um deles pode ter de 1 a 4 subníveis.
O diagrama de Linus Pauling indica a ordem de preenchimento dos subníveis por elétrons:


Obs.: As massas atômicas na tabela periódica são calculadas por uma média ponderada das massas dos isótopos de cada elemento encontrados na natureza.
Algumas famílias (colunas) de elementos possuem designação própria, por exemplo:
1 – metais alcalinos
2 – metais alcalinos terrosos
17 – halogênios
18 – gases nobres
Algumas propriedades da tabela periódica:

Exercícios:
(PUC-SP) O elemento de maior eletronegatividade é o que apresenta a seguinte configuração eletrônica:

(Fuvest) Os elementos químicos se relacionam de diferentes maneiras com os organismos vivos. Alguns elementos são parte da estrutura das moléculas que constituem os organismos vivos. Outros formam íons essenciais à manutenção da vida. Outros, ainda, podem representar riscos para os seres vivos: alguns, por serem tóxicos; outros, por serem radioativos.
Observe o esquema da Tabela Periódica, no qual estão destacados quatro elementos químicos, identificados pelas letras w, x, y e z:

Considerando suas posições na Tabela Periódica, assinale a alternativa que melhor associa esses quatro elementos químicos com as propriedades discutidas acima.

(Cesgranrio) Considerando um Grupo ou Família na Tabela Periódica, podemos afirmar em relação ao raio atômico:
a. Aumenta com o aumento do número atômico, devido ao aumento do número de camadas.
b. Aumenta à medida que aumenta a eletronegatividade.
c. Não sofre influência da variação do número atômico.
d. Diminui à medida que aumenta o número atômico, devido ao aumento da força de atração do núcleo.
e. Diminui com o aumento do número atômico, devido ao aumento do número de elétrons.


