Considere o sistema a seguir em que os átomos são representados por bolas:
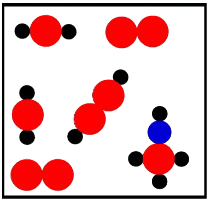
Em relação à imagem, podemos afirmar que ela apresenta:
a) 21 átomos
b) 6 substâncias
c) 5 moléculas
d) 4 elementos químicos diferentes
e) é uma mistura
Qual das alternativas a seguir não apresenta um dos postulados propostos por John Dalton em seu modelo atômico?
a) Substâncias químicas diferentes são formadas pela combinação de átomos diferentes.
b) Os átomos de diferentes elementos químicos apresentam propriedades diferentes uns dos outros.
c) O peso relativo de dois átomos pode ser utilizado para diferenciá-los.
d) Um átomo tem um conjunto de energia disponível para seus elétrons, isto é, a energia de um elétron em um átomo é quantizada.
e) Uma substância química composta é formada pela mesma combinação de diferentes tipos de átomos.
3. Para Dalton, o que era um átomo?
4. Segundo as ideias de Dalton, que característica diferenciava os átomos dos diversos elementos químicos?
5. Para Dalton, o que era um elemento químico?
6. Como Dalton representava os átomos? Como eles são representados atualmente?.
7. Como as ideias de Dalton a respeito das transformações químicas explicam:
a) a conservação da massa?
b) a proporção entre as substâncias participantes da reação?
Exercícios
1. Segundo a representação dos elementos químicos abaixo, o cálcio (Ca), o potássio (K) e o argônio (Ar) podemos classificá-los como isótopos, isótonos ou isóbaros?
20Ca40, 19K40, 18Ar40 Se na representação do elemento químico, o número de massa corresponde a soma dos prótons e dos nêutrons (A= p + n) na representação acima, nota-se que os números que aparecem na parte superior da letra são iguais: 40.Dessa forma, conclui-se que o cálcio, o potássio e o argônio são elementos isóbaros visto que possuem o mesmo número de massa (A) e diferentes números atômico (Z), estes, representado pelos números localizados na parte inferior do elemento (20, 19, 18).
2. De acordo com a classificação dos elementos químicos (isótopos, isóbaros e isótonos), agrupe os átomos apresentados:
90A232, 91B234, 90C233, 92D233, 93E234.
Note que todos os elementos acima apresentam o número de massa e o número atômico, contudo não apresentam o número de nêutrons. Dessa maneira, para agrupá-los segundo a classificação química (isótopos, isóbaros e isótonos), deve-se calcular o número de nêutrons presentes em cada elemento, pela fórmula (A= p + n):Elemento A: 90A232A= p + n232=90+n232-90=n142=n
Elemento B: 91B234A= p + n234=91+n234-91=n143=n
Elemento C: 90C233A= p + n233=90+n143=nElemento
D: 92D233A= p + n233=92+n141=nElemento
E: 93E234A= p + n234=93+n141=nLogo,
Os elementos A e C são isótopos pois possuem o mesmo número atômico e diferentes números de massa; os elementos (B e E) e (C e D) são isóbaros uma vez que possuem mesmo número de massa e diferentes números atômicos; e, por fim, os elementos (B e C) e (D e E) são isótonos pois apresentam o mesmo número de nêutrons e diferentes números de massa e número atômico.
03- (UNICENTRO-2007). Um cientista propôs o seguinte modelo atômico:“O átomo deve ter duas regiões: um núcleo denso, muito pequeno, com prótons e uma eletrosfera, uma região de volume muito grande, ocupada pelos elétrons. ”Essa proposta está de acordo com o modelo de
a) Chadwick.
b) Dalton.
c) Faraday.
d) Rutherford.
e) Thomson.
04- (UEPG-2007) A palavra átomo é originária do grego e significa indivisível, ou seja, segundo os filósofos gregos, o átomo seria a menor partícula da matéria que não poderia ser mais dividida. Atualmente esse conceito não é mais aceito.
A respeito dos átomos, assinale o que for correto.
( ) não podem ser desintegrados.
( ) o número de elétrons presentes no átomo é sempre maior que o número de prótons.
( ) a perda de um elétron do átomo leva à formação de um íon de carga negativa.
( ) apresentam duas regiões distintas, o núcleo e a eletrosfera.
( ) no átomo, todas as cargas positivas e quase toda a massa está concentrada no núcleo, enquanto que os elétrons carregados negativamente, circundam o núcleo e ocupam a maior parte do espaço do átomo.
05- (PUC-MG-2006). Assinale a afirmativa abaixo que NÃO é uma idéia que provém do modelo atômico de Dalton.
a) átomos de um elemento podem ser transformados em átomos de outros elementos por reações químicas.
b) todos os átomos de um dado elemento têm propriedades idênticas, as quais diferem das propriedades dos átomos de outros elementos.
c) um elemento é composto de partículas indivisíveis e di-minutas chamadas átomos.
d) compostos são formados quando átomos de diferentes elementos se combinam em razões bem determinadas.
06- (UNICAP-2003). Na época em que J. J. Thomsom conduziu seu experimento de raios catódicos, a natureza do elétron era uma dúvida. Alguns o consideravam uma forma de radiação; outros acreditavam que era uma partícula. Algumas observações feitas sobre os raios catódicos foram usadas para avançar em uma ou outra visão:
0.0 – eles passam através de folhas metálicas. Esta observação sustenta o modelo de partícula;
1.1 – viajam a velocidades mais baixas que a luz. Esta observação sustenta o modelo de partícula;
2.2 – se um objeto for colocado em seu caminho, eles apresentam uma sombra. Esta observação sustenta o modelo de radiação;
3.3 – seu caminho é defletido quando passam através de placas eletricamente carregadas. Esta observação sustenta o modelo de radiação;
4.4 – campo magnético é uma região de influência que afeta o movimento de partículas carregadas.
Exercício
Água H2O, Dióxido de Carbono CO2, Amoníaco NH3, Propano C3H8
Nome da substância Modelo da molécula Significado quantitativo e qualitativo
Molécula formada por 2 átomos de hidrogénio e 1 átomo de oxigénio
Molécula formada por 1 átomo de carbono e 2 átomos de oxigénio
Molécula formada por 1 átomo de azoto e 3 átomos de oxigénio Molécula
(UNESP) Observe as figuras 1, 2 e 3.
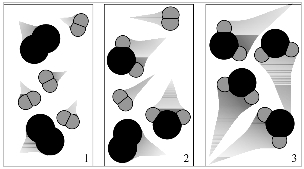
Elas podem representar diferentes momentos de uma reação entre:
a) os gases oxigênio e hélio.
b) os gases hidrogênio e oxigênio.
c) os gases hidrogênio e hélio.
d) os gases nitrogênio e cloro.
e) moléculas de iodo e oxigênio.
QUESTÃO 4
(UEPG) Estão representados abaixo quatro sistemas diferentes, nos quais as figuras de mesma forma e cor representam o mesmo elemento químico. Com base nessas informações, assinale o que for correto.
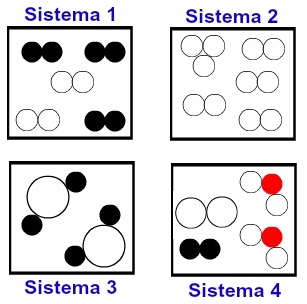
01. O sistema I contém somente substâncias simples.
02. No sistema II, ocorre alotropia.
04. O sistema III contém substância pura.
08. Os sistemas I e IV contêm misturas.
RESPOSTAS
Questão 1
Letra e). Na imagem, temos uma mistura porque há mais de uma substância (grupo de átomos). As outras alternativas estão incorretas porque:
a) Para determinar o número de átomos, basta somar as esferas presentes na imagem. Há 20 átomos na imagem.
b) Para determinar o número de substâncias, basta contar o número de moléculas que não se repetem. Na imagem, temos apenas 5, porque a molécula com dois átomos vermelhos repete-se.
c) Para determinar o número de moléculas, basta somar os grupos individuais de átomos. Na imagem, temos 6 moléculas.
d) Para determinar o número de elementos químicos, basta contar o número de esferas diferentes presentes na imagem, que é 3 (preta, azul e vermelha).
(FEI-SP) Se um átomo apresentar a massa atômica igual a 60 u, a relação entre a massa desse átomo e a massa do átomo de carbono 12 valerá?
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
QUESTÃO 2
Observe as afirmações a seguir e indique quais estão corretas:
- A unidade de massa atômica pode ser representada por u;
- A unidade de massa atômica é 1/12 da massa de um átomo de carbono;
- A unidade de massa atômica é 1/12 da massa do átomo de carbono de número de massa igual a 12;
- A massa atômica de um átomo é um número muito próximo de seu número de massa.
a) Todas.
b) Nenhuma.
c) Somente I, II e III.
d) Somente I, II e IV.
e) Somente I, III e IV.
QUESTÃO 3
Sabendo que a massa atômica de um átomo X é igual à massa de nove átomos de He, determine o número de átomos de carbono (12C), que apresenta uma massa igual à massa de um átomo X. (Massa atômica do He = 4).
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
QUESTÃO 4
(UFG) As medidas de massa são, na realidade, a comparação com um padrão definido de maneira adequada. O padrão adotado pela IUPAC para as medidas de massa atômica é um doze avos da massa do carbono – isótopo 12, que é denominado de unidade unificada de massa atômica.
Sobre massas de átomos, é correto afirmar que:
a) massa atômica é um número que indica quantas vezes a massa de um átomo é maior que um doze avos do carbono – isótopo 12;
b) os átomos de um mesmo elemento químico podem ter massas diferentes;
c) as massas atômicas são utilizadas atualmente para classificar os elementos da Tabela Periódica.


