Separação de Materiais
Projeto de Química Experimental
(Parte 1 – Introdução)
Uma atividade que realizamos com frequência é separar. Assim, um caixa de banco separa notas de valores diferentes, uma granja seleciona ovos de tamanhos diversos, etc. Nesses casos, a técnica consiste numa “escolha ou catação”. Entretanto, nem sempre o processo é tão simples, embora trabalhoso. Por exemplo, como separar indivíduos mentirosos de não mentirosos?
Em Ciências, frequentemente, também há necessidade de separar materiais e as técnicas empregadas dependem dos tipos de materiais que serão separados.
No presente conjunto de experimentos procuramos desenvolver várias técnicas de separação de materiais (filtração em papel-filtro, adsorção por carvão ativo, evaporação, destilação,etc.), indicando inclusive se o processo é adequado ou não a um tipo de mistura, além de explicações sobre o mecanismo de cada processo.
Na purificação da água, o aluno realizará em pequena escala parte do procedimento executado nas estações de tratamento, ocasião em que são separados da água os materiais indesejáveis.
Algumas técnicas, como, por exemplo, a da cromatografia, embora possa parecer sem interesse prático, constitui, na verdade, um precioso método de pesquisa científica, hoje largamente utilizado, o que torna aconselhável sua divulgação e emprego.
Os alunos poderão efetuar toda a série de experimentos aqui propostos ou o professor selecionará os que julgarem mais convenientes.
Objetivos
Familiarizar os alunos com várias técnicas de separação dos constituintes de diferentes misturas. Adquirir habilidade manual na execução dessas técnicas.
Preparação Prévia
Os experimentos da parte 2 até a parte 6 do título Separação de Materiais serão realizados com uma solução de azul-de-metileno, a qual deverá ser preparada pelo professor de acordo com as seguintes instruções:
Material
25 ml de álcool
10 mg de azul-de-metileno (pó)
1 bastão de vidro (18 cm x 0,5 cm)
1 funil de plástico (7 cm de diâmetro)
1 colher-medida de plástico
1 copo de vidro
1 frasco com tampa de rosca e rótulo (100 ml)
Preparação
Coloque o azul-de-metileno no copo (amostra do tamanho de uma cabeça de fósforo) e adicione o álcool. Agite com o bastão para ajudar a dissolução. Em seguida, acrescente água até encher o copo quase por completo e misture novamente. Esta é a solução-estoque, a partir da qual serão feitos os experimentos. Guarde-a no frasco tampado e rotulado.
Seguem os experimentos:
Parte 1 – Separação de materiais
Parte 2 – Filtração em papel-filtro
Parte 3 – Separação por adsorção em carvão
Parte 4 – Evaporação
Parte 5 – Destilação
Parte 6 – A destilação e a separação de líquidos
Parte 7 – Cromatografia em papel
Separação de Materiais
Projeto de Química Experimental
(Parte 4 – Evaporação)
Material
5 cm3 de solução azul-de-metileno
1 copo de vidro
1 funil de plástico (7 cm de diâmetro)
1 bastão de vidro (18 cm x 0,5 cm)
1 pinça de madeira
1 tubo de ensaio (15 mm x 150 mm)
1 estante para tubos de ensaio
1 lamparina a álcool
Álcool para queimar
Procedimento
a. Coloque o tubo de ensaio na estante.
b. Coloque a solução de azul-de-metileno no copo limpo e passe-a deste para o tubo de ensaio com o auxílio do funil e do bastão.
c. Acenda a lamparina.
d. Segure o tubo de ensaio com a pinça de madeira e leve-o sobre a chama da lamparina.
e. Espere a solução entrar em ebulição e deixe praticamente todo o líquido evaporar-se.
f. Observe o resíduo que fica no fundo do tubo de ensaio.
Resultado Esperado
Após a evaporação sobra um resíduo azul-escuro no fundo do tubo de ensaio.
(Parte 5 – Destilação)
Material
10 cm3 de solução de azul-de-metileno
cubo de gelo
2 tubos de ensaio (15 mm x 150 mm)
1 rolha de borracha (#16) com 1 furo de 4 mm de diâmetro
1 tubo flexível de plástico (50 cm de comprimento e 4 mm de diâmetro externo)
1 copo de vidro
1 suporte vertical metálico com base pesada
1 presilha
1 pinça metálica com cabo para prender o tubo de ensaio
1 funil de plástico (7 cm de diâmetro)
1 bastão de vidro (18 cm x 0,5 cm)
1 estante para tubos de ensaio
3 cacos de porcelana (pedrinhas de ebulição)
1 lamparina a álcool
Álcool para queimar
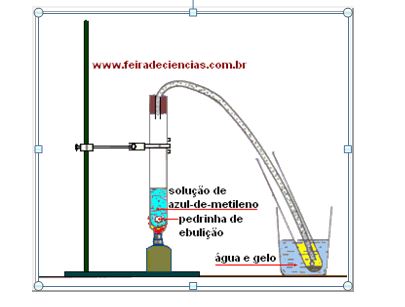
Procedimento
a. Introduza o tubo de plástico na rolha, ultrapassando-a aproximadamente 1 cm.
b. Coloque o tubo de ensaio na estante, passe a solução de azul-de-metileno para o copo e, deste, para o tubo de ensaio, usando a técnica já descrita. O líquido não deverá ultrapassar 1/3 da altura do tubo.
c. Acrescente ao tubo as pedrinhas de ebulição.
d. Monte o conjunto indicado na ilustração acima.
e. Aqueça cuidadosamente e observe o que acontece nos dois tubos de ensaio.
f. Quando o líquido azul no tubo de ensaio da esquerda estiver reduzido à metade ou menos, retire a extremidade do tubo de plástico de dentro do tubo de ensaio da direita e, só então, apague a lamparina.
Observação
Se a lamparina for apagada antes de se retirar o tubo plástico do tubo de ensaio onde está o líquido destilado, este será sugado de volta para o tubo da esquerda (refluxo).
Resultado Esperado
A mistura entra em ebulição. Os vapores formados percorrem o tubo de plástico e, ao atingirem uma região mais fria, condensam-se. O líquido condensado é incolor, diferente, portanto,da solução inicial.
(Parte 6 – A destilação e a separação de líquidos)
SITUAÇÃO DE APRENDIZAGEM 4
A PRODUÇÃO DO ÁLCOOL COMBUSTÍVEL
Nesta Situação de Aprendizagem, ampliaremos os conhecimentos sobre as transformações químicas, abordando dois importantes processos industriais – a fermentação alcoólica que levam à obtenção, respectivamente, do etanol Para isso, leia os textos a seguir.
Leitura e análise de texto
Texto 1 – Fermentação alcoólica na produção do etanol
O Brasil é um dos poucos países do mundo que utilizam álcool (etanol) como combustível automotivo. Esse fato garante ao país não apenas a posição de um dos maiores produtores de etanol do mundo, mas também de detentor da melhor tecnologia de produção de álcool a partir da cana-de-açúcar. Mas você sabe como é produzido o álcool a partir da cana-de-açúcar? A cana-de-açúcar é a principal matéria-prima usada na produção de álcool no Brasil. A
partir de 1 ha (um hectare, ou seja, 10 000 m2) de plantação, pode-se obter cerca de 3 mil litros de etanol. A cana-de-açúcar passa inicialmente pelo processo de moagem, em que o suco da cana, a garapa, é separado do bagaço, que pode ser queimado como combustível ou usado na alimentação do gado. Em seguida, a garapa é aquecida até que boa parte da água evapore e se forme um líquido viscoso e rico em açúcares, chamado melaço. Esse material é acidificado para que esteja em condições ideais para o desenvolvimento das leveduras (micro-organismos que possuem substâncias denominadas enzimas, capazes de acelerar a transformação de açúcares em álcool etílico e gás carbônico). É na presença das leveduras que o melaço passará pelo processo de fermentação alcoólica, que dura cerca de 50 horas, ocorrendo a formação do etanol.
A mistura obtida na fermentação apresenta cerca de 14% em volume de álcool, mas, após o processo de destilação, obtém-se álcool com 96° GL (4% de água e 96% de etanol). Para obter etanol puro (100%) pode-se adicionar cal viva ao álcool 96° GL. Nesse caso, haverá interação entre a cal e a água, formando um composto pouco solúvel em água e em etanol, o hidróxido de cálcio ou cal extinta, conforme as representações a seguir:
sacarose + água glicose + frutose
C12H22O11(aq) + H2O(l) àC6H12O6(aq) + C6H12O6(aq)
glicose ou frutose etanol + gás carbônico + energia
C6H12O6(aq) 2 à C2H5OH(aq) + 2 CO2(g) + energia térmica
óxido de cálcio + água A hidróxido de cálcio + energia
CaO(s) + H2O(l) à Ca(OH)2(s) + energia térmica
Embora tenhamos tratado aqui da produção do álcool a partir da cana-de-açúcar, essa não é a única matéria-prima da qual se pode obtê-lo. Além disso, o uso do álcool etanol não se restringe ao mercado de combustíveis, pois ele apresenta inúmeras outras aplicações na indústria e no dia a dia.
Objetivo
Compreender que a destilação pode ser usada para separar líquidos que tenham pontos de ebulição diferentes.
Material
10 ml de álcool em frasco de vidro com tampa de rosca
1 béquer (100 ml)
1 tubo de ensaio (15 mm x 150 mm)
1 termômetro (de -10°C a +110°C)
1 funil de plástico (7 cm de diâmetro)
1 estante para tubos de ensaio
1 lamparina a álcool
1 tripé (10 cm de altura x 8 cm de lado)
1 tela de amianto (10 cm de lado)
Álcool para queimar
Procedimento
a. Coloque o tubo de ensaio na estante e a haste do funil dentro do tubo de ensaio. Ao lado da estante, coloque o frasco com 10 ml de álcool tampado.
b. Sobre a mesma mesa, mas afastada do frasco com álcool, coloque a lamparina e o tripé com a tela.
c. Sobre a tela, coloque o béquer com água até a metade e o termômetro, como indica a ilustração (a).
d. Acenda a lamparina e aqueça a água até a ebulição. Observe a temperatura da água e anote a temperatura em que ela entra em ebulição.
Observação
Para ler a temperatura, erga um pouco o termômetro de modo a mantê-lo no meio do líquido e não encostado ao fundo do recipiente. Movimente-o cuidadosamente para misturar o líquido, uniformizando assim a temperatura.
- Apague o fogo, retire a lamparina e, somente depois disso, coloque o álcool no tubo de ensaio, rapidamente, através do funil. Retire o funil.
f.Retire o termômetro do béquer, enxugue-o rapidamente e mergulhe-o no tubo de ensaio com álcool.
g. Coloque o conjunto tubo-termômetro na água que acabou de ser aquecida, agite o tubo dentro da água e observe o que acontece com o álcool. Anote a temperatura indicada pelo termômetro; siga ilustração (b).
Resultados Esperados e Discussão
• A água ferve a 100°C ou um pouco abaixo dessa temperatura, dependendo da altitude do local e do grau de pureza da água.
- É possível que os diferentes grupos encontrem temperaturas diferentes para a ebulição da água. Isto pode ser explicado em termos de ligeiras diferenças entre os termômetros, imperfeições nas leituras feitas, transferência do calor das mãos para o termômetro, etc.
- O álcool, por sua vez, ferve a 78°C ao nível do mar, desde que seja puro. Os alunos deverão encontrar temperatura em torno desse valor, de acordo com as razões já expostas para a água.
- A destilação pode ser empregada para separar misturas quando as substâncias que dela fazem parte tenham, como a água e o álcool, pontos de ebulição convenientemente afastados. No caso particular da mistura álcool-água, o destilado ainda contém pequena porcentagem de água (mistura azeotrópica).
- Se o experimento da Parte 5 – destilação – fosse realizado utilizando-se, no tubo da esquerda, uma solução de água e álcool, a ebulição teria início aproximadamente a 78°C.


