Existem algumas substâncias que indicam o pH das soluções. Essas são conhecidas como indicadores ácidos-base. São consideradas inorgânicas algumas substâncias que contêm carbono, como o dióxido de carbono, monóxido de carbono, grafite, diamante, ácido carbônico, ácido cianídrico, e os sais carbonatos e cianetos. ![]()
Ácidos e bases: Definições de Arrhenius, Bronsted-Lowry e Lewis:
1 – Arrhenius:
- Ácidos são Substâncias que em solução aquosa liberam íons positivos de hidrogênio (H+).
- Bases são Substâncias que em solução aquosa, liberam hidroxilas, íons negativos OH–.
2 – Bronsted-Lowry:
- Ácido é uma substância capaz de ceder um próton a uma reação
- Base é uma substância capaz de receber um próton.
3 – Lewis
- Ácidos são substâncias que em numa ligação química, podem receber pares eletrônicos
- Bases são substâncias que cedem pares eletrônicos
Vamos relembrar como identificar ácido e base?
É possível medir a concentração de hidrogênio iônico em uma solução a partir de uma escala logarítmica inversa, que recebeu o nome de potencial hidrogeniônico, ou simplesmente, escala de pH.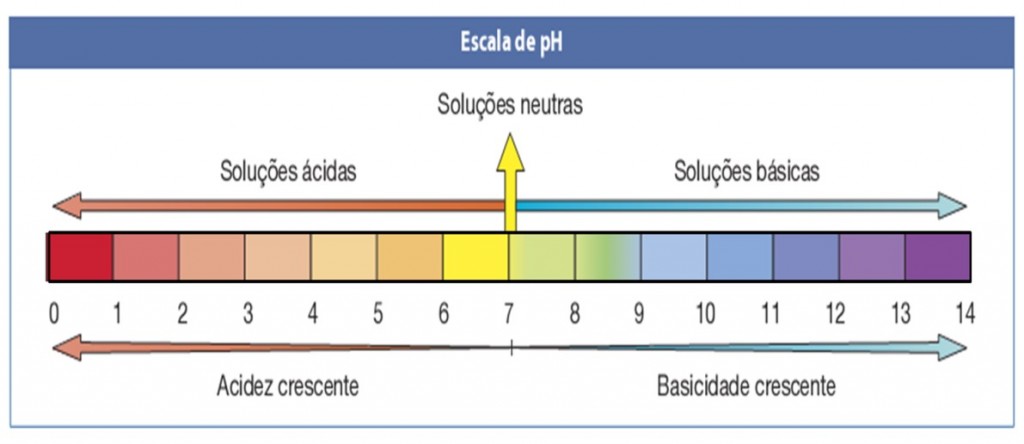
Esta escala vai de zero a 14, sendo o pH 7 considerado neutro. Os valores menores que sete classificam a solução medida como ácida e os maiores que sete, como alcalinos (bases)
Nomenclatura dos ácidos
Os ácidos podem ser divididos em dois grupos: que contém oxigênio (oxigenados) e os que não contêm (não oxigenados).
Nomenclatura dos ácidos
Os ácidos podem ser divididos em dois grupos: que contém oxigênio (oxigenados) e os que não contêm (não oxigenados).
Ácidos não oxigenados ou hidrácidos Exemplos:
Exemplos:
- HF – ácido fluorídrico HCl – ácido clorídrico
- HBr – ácido bromídrico HI – ácido iodídrico
- H2Se – ácido selenídrico H2Te – ácido telenídrico
Ácidos oxigenados ou oxiácidos
Quando forma apenas um oxiácido, segue a regra geral:
Ácido + nome do ânion + ico
Se formar mais de um oxiácido com Nox (número de oxidação) diferentes acrescenta-se os prefixos per ou hipo e os sufixos iço ou oso.
Exemplos:
HClO4 (Nox do cloro = +7; 4 átomos de oxigênio): ácido perclórico
HClO3 (Nox do cloro = +5; 3 átomos de oxigênio): ácido clórico – ácido padrão
HClO2 (Nox do cloro = +3; 2 átomos de oxigênio): ácido cloroso
HClO (Nox do cloro = +1; 1 átomo de oxigênio): ácido hipocloroso
A Nomenclatura de Ácidos e Bases
Nomenclatura das bases:

Exemplos:
NaOH – Hidróxido de sódio
Ferro → Fe2+ e Fe3+
Fe2+ Fe(OH)2 = Hidróxido de ferro (II) ou hidróxido ferroso.
Fe3+: Fe(OH)3 = Hidróxido de ferro (III) ou hidróxido férrico.
“O único lugar aonde o sucesso vem antes do trabalho é no dicionário”
(Albert Einstein)
Abaixo, tem-se a ilustração da interação entre as bases guanina e citosina, com as interações intermoleculares, mostradas com pontilhados.
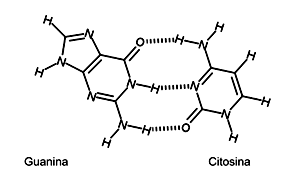
Assinale a alternativa correta sobre a interação que ocorre entre os dois pares de bases nitrogenadas, mostradas na ilustração.
2. (Mackenzie SP/2015)
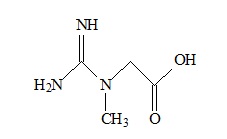
A creatina é um composto orgânico produzido pelo corpo dos vertebrados e é utilizada no interior das células musculares esqueléticas como fonte de energia. Ela é degradada em fosfocreatina e posteriormente em creatinina, após a realização de exercícios físicos. O seu nível é equilibrado pelos rins, assim a dosagem sorológica de creatinina visa medir a função renal de um indivíduo. De acordo com a fórmula estrutural da creatina, representada acima, são realizadas as seguintes afirmações:
I. Possui em sua estrutura ácido e base segundo a teoria de Bronsted-Lowry.
II. Apresenta os grupos funcionais amina primária, secundária e ácido carboxílico.
III. Possui dois carbonos que apresentam geometria trigonal plana.
Está correto o que se afirma em
(UFPR/2017)
Folhas de repolho-roxo exibem cor intensa devido à presença de pigmentos. Processando-se algumas folhas num liquidificador com um pouco de água, extrai-se um líquido de cor roxa, que, posteriormente, passa por uma peneira. Foram realizados os seguintes experimentos, seguidos das observações:
- Sobre volume de meio copo (~100 mL) do extrato líquido, adicionaram-se 20 mL de solução salina de cloreto de sódio (1 mol L–1). A cor roxa do extrato foi mantida.
- Sobre volume de meio copo do extrato líquido, adicionou-se suco de um limão. A cor do extrato líquido se tornou vermelha.
Foi observado aspecto opaco (turvo) no extrato líquido logo em seguida à sua separação das folhas de repolho, e esse aspecto se manteve durante todos os experimentos.
Sobre esse experimento, considere as seguintes afirmativas:
1. A mudança de cor de roxa para vermelha no segundo experimento é evidência de que ocorreu uma transformação química no extrato.
2. O extrato líquido é uma mistura homogênea.
3. Nos 20 mL de solução salina existem 1,2×1022 íons Na+ e 1,21022 íons Cl–.
Assinale a alternativa correta.
(UFPR/2017)
O ácido ascórbico é uma das formas da vitamina C que apresenta propriedade antioxidante. Na indústria de alimentos, ele é largamente utilizado como aditivo para prevenir a oxidação. Uma maneira de analisar a quantidade de ácido ascórbico em bebidas é através de uma reação de oxirredução utilizando iodo. Com base nisso, foi montada uma pilha, conforme ilustração abaixo, contendo eletrodos inertes de platina ligados a um voltímetro. Foram mantidas condições padrão (298 K, 1 atm e 1 mol L–1) para o experimento, e no instante em que se fechou o circuito, conectando-se os fios ao voltímetro, o valor de potencial medido foi de 0,48 V.
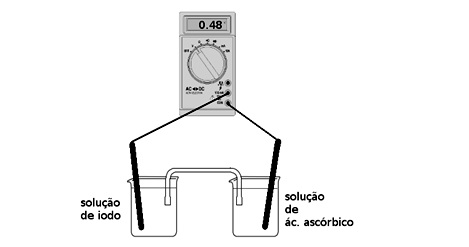
Sabendo que o potencial padrão de redução de iodo a iodeto é de E0 = 0,54 V, o potencial padrão da reação abaixo é:
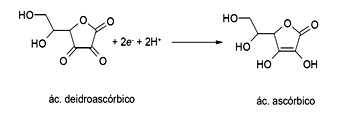
(UNITAU SP/2018)
O ácido lático (representado na figura abaixo), gerado pelo metabolismo celular, é produzido pela fermentação da glicose. A produção desse ácido pode ocorrer em condições de intensa atividade física, quando o suprimento de oxigênio é insuficiente no tecido muscular para oxidar a glicose. Quando há essa insuficiência, a glicose é convertida em ácido lático, para produção de ATP, sem a necessidade de O2.
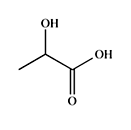
Com relação ao ácido lático, assinale a alternativa INCORRETA.
(UNITAU SP/2018)
A molécula de ATP contém a base adenina ligada à pentose, que está ligada a 3 grupos fosfatos, como apresentado na figura (a), em pH 7,4. A ligação entre os fosfatos é chamada de ligação fosfoanidrido. O ATP dentro das células pode se ligar com Mg2+, tal como apresentado na figura (b).
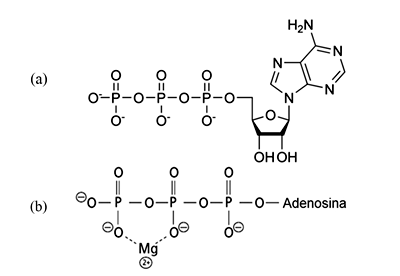
Nesse caso, o íon Mg2+ comporta-se
(UEA AM/2017)
É correto afirmar que soluções aquosas de hidróxido de sódio (soda cáustica)
(UNIFOR CE/2017)
A água é um dos melhores solventes, capaz de dissolver grande parte das substâncias conhecidas como sais, gases, açucares, proteínas, etc. Em muitas reações, apresenta um comportamento ambíguo ora atuando como ácido, ora como base.
Observe as equações abaixo:
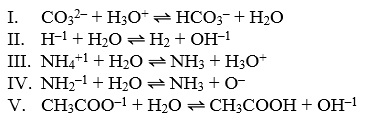
A água apresenta comportamento ácido de Bronsted-Lowry somente nas reações:
(ACAFE SC/2017)
Baseado nos conceitos sobre funções químicas inorgânicas, analise as afirmações a seguir.
I. O ácido fosforoso possui 3 hidrogênios ionizáveis.
II. Os nomes dos seguintes ânions ClO–, NO2–, CrO42– e P2O74– são, respectivamente: hipoclorito, nitrito cromato e pirofosfato.
III. Água régia corresponde a uma mistura de 3 partes de ácido nítrico para 1 parte de ácido clorídrico.
Assinale a alternativa correta.
(FCM MG/2017)
Este gráfico ilustra a titulação de 100,0 mL de uma solução aquosa de um ácido com solução aquosa de NaOH.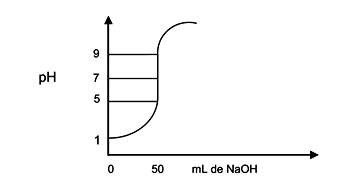
Analisando o gráfico, pode-se afirmar que


