Massas Atômicas e Massa Molecular
A massa atômica (MA) representa o quanto mais pesado que 1/12 de um átomo de carbono-12 um átomo de elemento químico qualquer é.Por exemplo, o Oxigênio tem massa atômica de 16u , pois é mais pesado 16 vezes em relação à 1 parte de 12 de um átomo de carbono-12.
O átomo de Helio possui 4u , ou seja, sua massa é o equivalente à 1/3 da massa de um átomo de 12C.
Obs: muitas vezes o u da unidade é omitido em tabelas periódicas ou provas de vestibulares.
Massa atômica de um elemento químico
Os elementos químicos podem possuir vários isótopos (mesmo número atômico porém massa diferente), mas não seria viável representá-los todos na tabela periódica. Por isso, as massas atômicas que vemos nessas tabelas, são médias ponderadas das massas dos diversos isótopos estáveis existentes no universo que esse elemento químico possui.
Por exemplo, o oxigênio possui três isótopos estáveis:
– 16O – MA = 16u , equivale à 99,7% de todos os átomos de oxigênio do universo
– 17O – MA = 17u , são apenas 0,03% dos átomos de O
– 18O – MA = 18u , abundância de 0,2%
Fazendo a média ponderada:
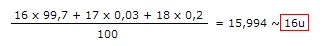
Como era previsto, a média ponderada deu um valor próximo à 16, já que 99,7% dos átomos de oxigênio possuem essa MA.
Agora veremos o exemplo do Cloro. Isótopos estáveis de cloro:
– 35Cl – MA = 35u , representa 75,4% dos átomos de cloro
– 37Cl – MA = 37u , é 24,6% dos átomos de cloro
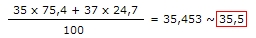
Massa Molecular
A massa molecular (MM) é a soma das massas atômicas dos átomos que compôem uma molécula. Por exemplo, numa molécula de água (H2O) , teremos:
– H = 1u , como são dois hidrogênios = 2u
– O = 16u
– H2O = 2u + 16u = 18u


