Aula
Combustíveis: combustão no DIA A DIA e no sistema produtivo
Conteúdos e temas: uso de diferentes combustíveis; caloria; poder calorífico; reação de combustão.
Competências e habilidades: analisar dados referentes às massas e à energia envolvida na queima de combustíveis, estabelecendo relações de proporcionalidade entre essas duas grandezas.
Sugestão de estratégias de ensino: levantamento das ideias dos alunos; exposição dialogada.
Sugestão de recursos: lousa e giz; questões presentes neste Caderno.
Sugestão de avaliação: respostas às questões e participação nas aulas
Combustão e Energia
Para reflexão:
- Por que quando o motor do carro está desregulado este gasta mais gasolina?
- Qual dos combustíveis, a gasolina, o álcool ou o diesel produz menos SO2?
- O que é um combustível ‘limpo’?
Energia
O ser humano necessita de energia para tudo que faz, desde impulsionar o sangue para todas as partes de seu corpo, até fazer com que uma lâmpada se acenda ou que um automóvel se locomova. Mas como obter tal energia?
Para o funcionamento do corpo utilizamos a energia dos alimentos. Já para a obtenção de energia elétrica, mecânica, etc… existem várias fontes, dentre elas estão:
- o biocombustível (álcool proveniente da cana de açúcar, ou diesel a base de óleo vegetal como de amendoim, soja, girassol, mamona, pequi, babaçu);
- a gasolina, (obtida pela destilação fracionada do petróleo);
- energia termoelétrica (obtida pela queima do carvão ou gás natural);
- a energia eólica (resultado do movimento do vento);
- a energia solar (aquece placas especiais que transformam essa energia em elétrica)
- a energia hidroelétrica (uso da energia das quedas d’água para acionar geradores)
- energia nuclear (baseada na fissão, ou seja, na divisão do átomo);
- o biogás (metano, CH4), também conhecido como gás natural (produzido pela fermentação e decomposição da matéria orgânica por microorganismos).
A energia solar, eólica, hidroelétrica o biocombustíveis são chamadas de energias renováveis, pois os raios solares e ventos são produzidos constantemente, a água que é utilizada para mover uma turbina em uma hidroelétrica pode ser renovada pela chuva que enche novamente o reservatório, e a cana-de-açúcar utilizada para produzir álcool pode ser plantada novamente. Já o petróleo, o gás natural e o carvão, são produtos finitos provenientes de fósseis de vegetais e animais que habitaram a Terra alguns milhões de anos atrás. A produção de energia nuclear depende do urânio, que também é um recurso finito. Estas são chamadas de energias não renováveis.

Triângulo do Fogo – conceitos básicos
Fogo é uma reação química que precisa de três componentes bem equilibrados para que venha a existir e produzir luz e energia térmica em forma de calor. Para isso devemos entender e conhecer quais seriam estes componentes.
Basicamente são 3 elementos: fonte de ignição (calor) comburente e combustível que reagindo em cadeia originam o fogo. É importante conhecer cada um deles.
Combustível
Podem ser sólidos, líquidos ou gasosos. Os combustíveis sólidos são muito conhecidos no dia-a-dia popular através do carvão – relacionado frequentemente a churrascos – mas existem vários outros como a lenha – visto em várias pizzarias que ainda mantém o tradicional “fogão a lenha” para o preparo de pizzas. A nível industrial o xisto pode ser citado como um exemplo.
Os combustíveis líquidos (gasolina, álcool, querosene, etanol, entre outros) são substâncias compostas de hidrocarbonetos que proporcionam fogo se submetidos a determinadas condições.
Já os combustíveis gasosos, por não possuir volume definido, espalham-se pelos ambientes a que estão confinados, porém possuem facilidade para dispersão se submetidos a ventilação.
Comburente
O oxigênio é o comburente mais comum – existem outros como o óxido nitroso, hidrogênio. Ele possibilita a reação química com o hidrocarboneto (seja ele sólido, líquido ou gasoso) e proporciona a liberação térmica do combustível mais a liberação de dióxido de carbono – considerando uma reação química ideal, pois em muitos casos a queima ocorre imperfeita, liberando também monóxido de carbono e outros gases.
Fonte de ignição (calor)
É através desta fonte que tudo se inicia, ou seja, se houver a presença de um combustível misturado/colado com um comburente e não houver uma fonte de calor, nada ocorre. Entra em reação em cadeia espontânea após a “partida” dada pela fonte de ignição.
Vejamos um exemplo prático: quando vamos acender o fogo de uma boca de fogão fica visível cada uma das etapas; o gás saindo pelo queimador, entra em contato com ar a até aí nada acontece. Vem o fósforo ou a faísca do acendedor automático e o fogo inicia.
Destes três elementos consideramos o combustível o mais perigoso, pois convivemos com o oxigênio na atmosfera, a fonte de ignição geralmente só ocorre se acionada e o combustível geralmente se apresenta em grande concentração e pode entrar em reação de maneira perigosa.
Combustão completa e incompleta
A combustão é uma reação de uma substância (combustível) com o oxigênio (O2) (comburente) presente na atmosfera, com liberação de energia.
COMBUSTÍVEIS
No sentido tradicional, combustíveis são materiais que emitem calor ao reagirem com o oxigênio, num processo de combustão. Esta propriedade permite que uma quantidade de massa de um combustível desempenhe o papel de reservatório de energia, capaz de armazená-la em sua estrutura química até o momento de ser usada.
A quantidade de energia, sob a forma de calor, que um combustível pode fornecer quando queimado completamente chama-se poder calorífico. No caso do automóvel, os combustíveis mais comuns são a gasolina e o álcool, cujos poderes caloríficos típicos são, respectivamente, 9600 e 6100 kcal/kg.
O poder calorífico da gasolina é superior ao do álcool, portanto, carros movidos a etanol apresentam maior consumo de combustível, em comparação aos que utilizam o derivado de petróleo, (estando ambos em condições idênticas de desempenho mecânico!!).
Entalpia (ΔH)
A liberação ou consumo de energia durante uma reação é conhecida como variação da entalpia (ΔH), isto é, a quantidade de energia dos produtos da reação (Hp) menos a quantidade de energia dos reagentes da reação (Hr):
ΔH = Hp – Hr
Quando ΔH > 0 isto significa que a energia do(s) produto(s) é maior que a energia do(s) reagentes(s) e a reação é endotérmica, ou seja, absorve calor do meio ambiente. Quando ΔH < 0, isto significa que a energia do(s) reagente(s) é maior que a energia do(s) produto(s) e a reação é exotérmica, ou seja, libera calor para o meio ambiente, como no caso da combustão da gasolina, por exemplo.
A combustão completa de qualquer combustível orgânico (que possui átomos de carbono) leva a formação de gás carbônico ou também chamado de dióxido de carbono (CO2) e água (H2O). A respiração é um processo de combustão, de “queima de alimentos” que libera energia necessária para as atividades realizadas pelos organismos. É interessante notar que a reação inversa da respiração é a fotossíntese, que ocorre no cloroplasto das células vegetais, onde são necessários gás carbônico, água e energia (vinda da luz solar) para liberar oxigênio e produzir material orgânico (celulose) utilizado no crescimento do vegetal.
combustão/respiração
C6H12O6(s) + 6 O 2(g) ↔ 6 CO2(g) + 6 H2O (l) + energia
fotosíntese
A gasolina possui muitas impurezas contendo enxofre (S), e o diesel, ainda mais. Hoje no Brasil existe um grande investimento por parte da Petrobrás para diminuir a concentração de enxofre no diesel e assim torná-lo menos poluente. Portanto, combustíveis que tem enxofre, ao serem queimados produzem grandes quantidades de um gás bastante tóxico e corrosivo, responsável por acidificar a atmosfera, o dióxido de enxofre (SO2). Já o álcool é um combustível que não apresenta enxofre e portanto não produz o dióxido de enxofre.
S(s)+ O2(g ) → SO2(g)
A falta de oxigênio durante a combustão leva à chamada ‘combustão incompleta’ que produz monóxido de carbono (CO).
Note que o CO tem um oxigênio a menos que o CO2, o que caracteriza a deficiência de oxigênio, ou a ineficiência da reação. Este gás é muito tóxico para o ser humano, pois este dificulta a função da hemoglobina, que é responsável pela renovação do oxigênio no nosso sangue. Pequenas concentrações de monóxido de carbono já provocam tonturas e dores de cabeça. Outro produto indesejável da combustão incompleta é a fuligem (C), que não tem oxigênio na sua constituição. A porção mais fina da fuligem pode impregnar nos pulmões e causar problemas respiratórios.
As equações químicas abaixo ilustram a quantidade de calor (ΔH) liberada durante a combustão completa e incompleta do gás metano (CH4). Note como a quantidade de calor liberado é menor nos casos de combustão incompleta. Portanto, além da combustão incompleta gerar compostos nocivos à saúde humana, há também uma grande desvantagem econômica, pois com a mesma quantidade de combustível haverá menor quantidade de energia gerada! Veja as equações:
Combustão completa do metano:
CH4(g) + 2O2(g) → CO2(g) + 2H2O (l) ΔH = – 802 kJ/mol (energia liberada)
Combustão incompleta do metano:
CH4(g) + 3/2 O2(g) → CO(g) + 2H2O(l) ΔH = – 520 kJ/mol
CH4(g) + O2(g) → C(s) + 2H2O(l) ΔH = – 408,5 kJ/mol
É muito importante saber a quantidade de calor liberada pelos combustíveis para que seja possível comparar o valor energético de cada um deles.
Na Tabela 1 são mostradas as entalpias de combustão (ΔHo) para alguns combustíveis, isto é, a energia liberada na queima completa de um mol do combustível. O zero utilizado como índice superior indica que as condições iniciais dos reagentes e as finais dos produtos são 25o C e 1 atm, chamadas de condições padrão.
Tabela 1: Entalpia de combustão padrão para vários combustíveis.
COMBUSTÍVEL |
FÓRMULA MOLECULAR |
ΔH° (kJ/mol) |
| Carbono (carvão) | C(s) | – 393,5 |
| Metano (gás natural) | CH4 (g) | – 802 |
| Propano (componente do gás de cozinha) | C3H8 (g) | – 2.220 |
| Butano (componente do gás de cozinha) | C4H10 (g) | – 2.878 |
| Octano (componente da gasolina) | C8H18 (l) | – 5.471 |
| Etino (acetileno, usado em maçarico) | C2H2 (g) | – 1.300 |
| Etanol (álcool) | C2H5OH (l) | – 1.368 |
| Hidrogênio | H2 (g) | – 286 |
Veremos mais tarde, na seção experimento, que mesmo a combustão completa leva a produção de um gás indesejável, que é o dióxido de carbono, o maior responsável pelo chamado efeito estufa. Desta forma, o combustível menos poluente que se conhece é o hidrogênio, pois sua combustão gera apenas água:
H2(g) + ½ O2(g) → H2O(l) ΔH = – 286 kJ/mol
Química do automóvel – Combustão da gasolina e do álcool
Em física do automóvel, vimos que o motor a explosão que movimenta os carros é uma máquina térmica, ou seja, transforma calor em trabalho e obedece às equações da física que descrevem como os gases aumentam sua pressão e se expandem quando aquecidos.
A mecânica é a ciência do movimento e o ramo da física que explica como pressões e volumes de gases fazem os veículos andarem. Mas, o princípio de todo este processo é entendido através da química, uma vez que toda produção de trabalho requer o fornecimento de uma quantidade de energia no mínimo igual ao trabalho gerado.
Os fenômenos que tornam o automóvel uma máquina viável acontecem no pequeno mundo das moléculas.
PODER DE EXPLOSÃO
Além do poder calorífico, outra propriedade importante dos combustíveis é a maneira como eles explodem, ou suas características de detonação.
Para funcionar satisfatoriamente, não basta o motor a explosão ser alimentado por um combustível capaz de explodir. É indispensável que a explosão ocorra de um modo regular, no tempo e no modo projetado, para provocar o aproveitamento esperado das pressões internas, sem produzir ondas de choque que possam danificar os mecanismos.
Para garantir esta regularidade, a gasolina é aditivada com substâncias antidetonantes, que funcionam como retardadores químicos da explosão e garantem que esta só aconteça no momento certo do ciclo.
Por muito tempo, o antidetonante mais usado foi o chumbo tetraetila, um composto altamente nocivo à saúde e ao meio ambiente. Hoje, no Brasil, determinadas quantidades de álcool são adicionadas à gasolina, exercendo a função antidetonante em substituição aos compostos de chumbo.
ESTEQUIOMETRIA
Para que a queima do combustível ocorra dentro dos padrões técnicos do ciclo e a expansão dos gases produza a pressão e o trabalho desejados, é necessário que a massa de combustível injetada no motor seja misturada a uma quantidade de ar. Forma-se assim a mistura combustível-ar, cuja dosagem é feita pela injeção eletrônica ou pelo carburador.
A gasolina é uma mistura de vários hidrocarbonetos, que, na média típica, pode ser representada por C8H18.
Assim, a estequiometria da combustão completa da gasolina é definida na equação:

Seguindo o mesmo princípio, a combustão completa do etanol segue a equação abaixo (desconsiderada a fração de água que o caracteriza como hidratado):

Estas proporções estabelecem a quantidade mínima de ar necessária para fornecer a quantidade de oxigênio requerida pela queima completa dos combustíveis, considerando que o ar atmosférico possui 21% de oxigênio e 79% de nitrogênio.
Se multiplicarmos as quantidades moleculares por seus respectivos números de massa, veremos que as proporções estequiométricas da mistura combustível-ar para gasolina e álcool são:

Ou seja, são necessárias 15 unidades de massa de ar para cada unidade de massa de gasolina injetada no motor.

Ou seja, são necessárias nove unidades de massa de ar para cada unidade de massa de álcool injetada no motor.
É importante reiterar que estes cálculos são ideais, ou seja, consideram apenas as estequiometrias das massas de combustível e de ar para uma reação de combustão completa. Normalmente, os veículos trabalham com a chamada mistura econômica, que admite um excesso de ar para aumentar a eficiência da combustão.
REAÇÕES DE COMBUSTÃO
Quando passamos do ideal para o real, a combustão no motor é incompleta. As reações de oxidação, que deveriam combinar oxigênio e carbono, gerando dióxido de carbono (CO2), não se completam, resultando na formação de monóxido de carbono (CO), um poluente tóxico.
Os combustíveis possuem ainda outras substâncias químicas em sua composição, que reagem na combustão formando outros compostos. Um exemplo é o enxofre, presente na gasolina, que reage com o oxigênio ou hidrogênio formando SO2 e H2S.
A combustão incompleta também produz óxidos de nitrogênio (NOx), hidrocarbonetos, aldeídos e particulados, além da fuligem preta típica dos motores mal regulados.
Um dos modos de checagem de injeções eletrônicas modernas é a análise da proporção de CO nos gases de escape. Quanto maior a proporção, em comparação às especificações do motor, mais incompleta é a queima e menos eficiente o processo de dosagem da mistura combustível-ar.
Há muito mais sobre a química dos automóveis do que o exposto neste breve exemplo, mas ele apresenta uma interessante mostra do quanto esta ciência nos ajuda a ir adiante, neste caso, literalmente.
Lista de Exercícios
Questão 1
Identifique a reação que define a variação da entalpia-padrão de formação:
a) 2 C(grafite) + 2 O2(g) → 2 CO2(g)
b) C(diamante) + O2(g) → CO2(g)
c) C(grafite) + O2(g) → CO2(g)
d) CaO(s) + 3 CO2(g) → CaCO3(g)
e) N2(g) + 3 H2(g) → 2 NH3(g)
Questão 1
Alternativa “c”.
Para ser a variação da entalpia-padrão de formação, é preciso que os reagentes sejam substâncias simples, no estado padrão e na sua forma alotrópica mais estável (o C(grafite) é a forma alotrópica do carbono mais comum), além de haver a formação de 1 mol de substância.
Questão 2
Do conjunto de substâncias abaixo, quais devem ter entalpia-padrão de formação (∆H0f) igual a zero:
a) água líquida.
b) nitrogênio gasoso.
c) oxigênio gasoso.
d) grafita.
e) diamante.
Questão 2
Alternativas “b”, “c” e “d”, porque essas são as substâncias que, a 1 atm de pressão e 25 ºC, encontram-se na sua forma alotrópica mais estável.
QUESTÃO 3
(PUC-MG) Sendo o ΔH de formação do óxido de cobre II igual a –37,6 kcal/mol e o ΔH de
formação do óxido de cobre I igual a –40,4 kcal/mol, o ΔH da reação:
Cu2O(s) + 1/2 O2(g) → 2 CuO(s)
será:
a) –34,8 kcal.
b) –115,6 kcal
c) –5,6 kcal.
d) +115,6 kcal.
e) +34,8 kcal.
Questão 3
Alternativa “a”.
O óxido de cobre II é CuO= -37,6 kcal/mol
O óxido de cobre I é Cu2O= -40,4 Kcal/mol
1 Cu2O(s) + 1/2 O2(g)* → 2 CuO (s)
1mol . (-40,4) + 0 ——————- 2 mol . (-37,6)
HR=(-40,4) ——————————-HP=( -75,2)
* Observação: No 1/2 O2(g), o valor da entalpia é zero porque a toda substância simples no estado padrão atribui-se valor zero.
Sabendo que a variação da entalpia é ∆H = HP – HR
∆H=( -75,2)-(-40,4)
∆H=( -75,2)+40,4
∆H=-34,8 kcal
Questão 4
Alternativa “b”.
Ca(OH)2(s) + CO2(g) → CaCO3(s) + H2O(g)
∆H = HP – HR
∆H = ( HCaC
QUESTÃO 4
(UNI-RIO) Os romanos utilizavam CaO como argamassa nas construções rochosas. O CaO era misturado com água, produzindo Ca(OH)2, que reagia lentamente com o CO2‚ atmosférico, dando calcário:
Ca(OH)2(s) + CO2(g) → CaCO3(s) + H2O(g)
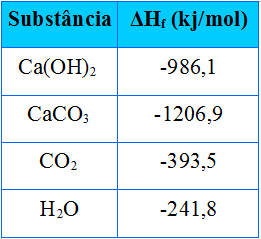
A partir dos dados da tabela anterior, a variação de entalpia da reação, em kJ/mol, será igual a:
a)138,2
b) – 69,1
c)-2828,3
d)+ 69,1
e)-220,8
Alternativa “b”.
Ca(OH)2(s) + CO2(g) → CaCO3(s) + H2O(g)
∆H = HP – HR
∆H = ( HCaCO + HH2O ) – (HCa(OH)2+ HCO2)
∆H = ( – 1206,9 – 241,8 ) – (-986,1 – 393,5)
∆H = -1448,7 -(-1379,6)
ΔH= -1448,7+1379,6
ΔH= -69,1 kJ/mol



