Aula 1.
Acordo Pedagógico. Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania.
“Amarás ao teu próximo como a ti mesmo”. Respeito Mútuo é o principal compromisso ético que todo ser humano deve assumir é o de tratar as pessoas como pessoas, procurando entender o ponto de vista do outro mesmo que não esteja de acordo com seu princípios e teorias.
Nosso intuito é ajudar crianças e adolescentes a aprenderem a aprender, a buscarem o desenvolvimento a serem protagonistas da própria aprendizagem como ser integral e vislumbrarem suas potencialidades de ação social.
Não seja vítima da sua própria história! Não espere que alguém faça por você aquilo que só você pode fazer; escrever a sua história. Não seja manipulado por discursos políticos que promovem o coitadíssimo e por isso merecem uma recompensado Estado. Nossa recompensa é o fruto que colhemos. A colheita é consequência do que plantamos. Nada funciona de forma diferente, se você plantar e perseverar, você vai colher.
O estudo da Ciência no Ensino Médio também tem como objetivo prepara-lo para o mundo de trabalho e o exercício da cidadania, da ética, da prática da autonomia intelectual e do pensamento crítico; Isto quer dizer que esta fase da escolaridade tem, entre outras funções a de torná-lo apto a planejar, executar e avaliar ações de intervenção em sua realidade, que é a escola, o trabalho ou outras circunstâncias relevantes da sua vida.
O QUE PRECISO FAZER?
Fazer os trabalhos ou pesquisas sempre no caderno, em folha separada, colocar cabeçalho, fazer resumo das ideias principais, colocar a fonte. Na sala de aula faremos discussão das pesquisas.
A leitura do texto é um dos recursos na construção de significados atribuídos a determinado objeto de ensino. Pretende-se utiliza-lo como desencadeadora é motivadora para a aprendizagem das transformações químicas.
Outra coisa interessante a se fazer é consultar um dicionário sempre que escutar ou ler uma palavra que você não tenha familiaridade ou não tenha certeza do seu significado. Assim, além de aumentar seu vocabulário, você conseguirá uma correta interpretação de sua leitura.
ESTRATÉGIAS
Desenvolve aulas a partir de um levantamento prévio do conhecimento dos alunos, solicita pesquisas sobre o tema para introduzir o conteúdo utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apoia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros.
RECURSOS
Conteúdos retirados de livros didáticos, apostilas, pesquisas, vídeos, exemplos e experimentos.Análise de situações do cotidiano e suas relações com os conteúdos trabalhados.Livro Didático (Química na abordagem do cotidiano), Caderno do aluno.
AVALIAÇÃO
• Todas as atividades desenvolvidas pelos estudantes serão avaliadas no processo de aprendizagem. Aula dada aula avaliada!
• 5,0 pontos (Avaliação atitudinal): responsabilidade, pontualidade, participação em aula, tarefas de casa, comprometimento, empenho em aprender, respeito e tolerância às limitações dos colegas, disciplina, cooperação, frequência, caderno, apostila, participação em projetos.
• 3,0 pontos (Avaliação conceitual): exercícios de fixação e prova.
• 2,0 pontos Experimentos, (Pesquisas ou trabalhos:serão feitos no caderno avaliadas considerando os seguintes critérios: Tema; Resumo; Conclusão; Organização; escrever no mínimo 30 linhas, Bibliografia; Apresentação.
RECUPERAÇÕES DA APRENDIZAGEM
O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma
-2019 será um ano de transição, estudos e testes;
– O currículo paulista ainda não foi aprovado, não haverá material de transição;
– Não renovaram os direitos autorais dos cadernos do professor e aluno, enquanto isso é para usar o livro didático, virá um material de transição, estão separando dos cadernos de apoio o que não tem direito autoral, secretário quer a construção do material com a rede;
-kits escolares chegarão até o final de março;
– a AAP será mantida mas a licitação só iniciou esse ano, ADE vai atrasar;
TEMAS PARA PESQUISAS:
Atividade 1 – O meio ambiente na constituição, poluição da atmosfera
Atividade 2 – A atmosfera pode ser considerada uma fonte de materiais úteis para o ser humano?
Atividade 3 – Estudo da síntese e da produção industrial da amônia a partir dos gases nitrogênio e hidrogênio
Atividade 4 – É possível alterar a rapidez com que uma transformação química ocorre?
Atividade 5 – Como utilizar modelos microscópicos para explicar as diferenças na rapidez das transformações químicas?
Atividade 6– Composição das águas naturais e usos da água doce
Atividade 7 – Entendendo a escala de pH
Atividade 8 – Como saber as quantidades de produtos e de reagentes que coexistem em equilíbrio químico?
Atividade 9 – Influência das variações de temperatura e pressão em sistemas em equilíbrio químico
Atividade 10– Como o ser humano usa a água do mar para sua sobrevivência?
Atividade 1– ATMOSFERA PODE SER CONSIDERADA UMA FONTE DE MATERIAIS ÚTEIS PARA O SER HUMANO.
Competência e habilidades. Desenvolver a leitura e a interpretação de textos, compreender e refletir em linguagem discursiva. Tomar consciência dos conteúdos avaliações e forma de trabalho
4ª semana 19/02/2018 a 23/02/2018
COMPOSIÇÃO DO AR ATMOSFÉRICO PARTE 2.
Competência e habilidades. Compreender o processo da destilação fracionada no nível macroscópico para poder explicá-lo no nível microscópico.
6ª/7ª semanas 12/03/2018 a 16/03/2018
Situação de Aprendizagem 3 –É POSSÍVEL ALTERAR A RAPIDEZ COM QUE UMA TRANSFORMAÇÃO QUÍMICA OCORRE?
Competência e habilidades.Organizar, relacionar e interpretar dados para chegar a conclusões sobre as variáveis que podem alterar a rapidez que uma transformação química ocorre? Recorrer aos conhecimentos desenvolvidos sobre as variáveis que podem afetar a rapidez do processo de deterioração dos alimentos para a elaboração de propostas de intervenção solidária na sociedade; reconhecer o papel da Química no sistema produtivo, analisando a importância dos estudos relacionados aos catalisadores.
8ª/9ª semanas 19/03/2018 a 30/03/2018
Situação de Aprendizagem 4 – COMO UTILIZAR MODELOS MICROSCÓPICOS PARA EXPLICAR AS DIFERENÇAS NA RAPIDEZ DAS
TRANSFORMAÇÕES QUÍMICAS? Aplicar modelos microscópicos para explicar os fatores que podem afetar a rapidez das transformações químicas; desenvolver conexões hipotéticas utilizando modelos microscópicos que possibilitam previsões acerca das diferenças na rapidez das transformações químicas.
12ª semana 16/04 a 20/04/2018
Situação de Aprendizagem 5 – Composição das águas naturais e usos da água doce?
CONTÉUDOS E TEMAS:Distribuição de água no planeta; características da água doce para diferentes formas de consumo.
COMPETÊNCIA E HABILIDADES.Interpretar dados apresentados em tabelas relativos á disponibilidade de água no planeta, á qualidade e aos usos das águas.
13ª semana 23/04 a 27/04/2018
Situação de Aprendizagem 6 – Entendendo a escala de pH.
CONTEÚDOS E TEMAS:Definição de pH e a importância de seu controle- condutibilidade elétrica e auto ionização da água; produto iônico da água – como explicar o pH = 7; conceito de equilíbrio químico; auto ionização da água – explicações no nível microscópico; acidificação e alcalinização da água; transformações de neutralização entre ácidos e bases fortes – formação de sais.
COMPETÊNCIA E HABILIDADES.
Ler e interpretar textos referentes á importância do controle de pH no sistema produtivo; estabelecer relações entre os conhecimentos químicos de pH e as ideias de Arrhenius; entender o processo de auto ionização da água em nível microscópico; compreender, nos níveis macroscópico e microscópico, qualitativo e quantitativo, que a adição de solutos pode modificar o pH da água.
14ª semana 30/04 a 04/05/2018
Situação de Aprendizagem 7 – Como saber as quantidades de produtos e de reagentes de produtos e de reagentes que coexistem em equilíbrio químico.
CONTÉUDOS E TEMAS:Dissolução de ácidos e bases em água; retomada do conceito de Arrhenius; construção empírica da expressão da constante de equilíbrio químico; relação entre o valor da constante de equilíbrio e a extensão de uma transformação química; extensão da dissociação iônica- força de ácidos e de bases.COMPETÊNCIA E HABILIDADES. Ler e interpretar e analisar textos e tabelas que utilizam dados referentes à acidez de soluções; relacionar valores de pH com extensão do processo de dissociação iônica; compreender o significado da constante de equilíbrio e saber aplica-la na previsão da extensão das transformações.
15ª semana 07/05 a 11/05/2018
Situação de Aprendizagem 8 – Influencia das variações de temperatura e pressão em sistemas em equilíbrio químico.CONTÉUDOS E TEMAS:
Perturbações no estado de equilíbrio químico provocados por mudanças de temperatura ou de pressão.COMPETÊNCIA E HABILIDADES.
Fazer uso das linguagens próprias da Química e da Matemática para obter informações sobre a concentrações presentes em equilíbrios químicos; avaliar dados referentes às perturbações em sistemas que já atingiram o equilíbrio químico causadas por mudanças de pressão ou de temperatura; prever mudanças em equilíbrios químicos aplicando o principio de Le Chatelier.
16ª semana14/05 a 18/05/2018
Situação de Aprendizagem 9 – Como o ser humano usa a água do mar para sua sobrevivência?
CONTEÚDOS E TEMAS:Permitem a obtenção de produtos a partir da água do mar: separação do sal por evaporação; eletrólise ígnea do cloreto de sódio eletrolise da salmoura e processo Solvay para obtenção do carbonato de sódio químico; conceitos retomados: solubilidade, eletrólise e equilíbrio químico; conceito novo; perturbação de equilíbrios químicos por mudanças nas concentrações de espécies participantes.
COMPETÊNCIA E HABILIDADES. Fazer uso da linguagem química para representar e expressar sistemas químicos em equilíbrio químico e transformações de oxirredução; interpretar dados apresentados em tabelas relativos á composição, à produção e ao consumo do cloreto de sódio e aplicar as informações obtidas para entender a importância da água do mar como fonte de matérias-primas; interpretar esquemas que representam processos industriais e relacioná-los com os conhecimentos que já possuem ou recém-aprendidos; reconhecer como fatores que afetam o equilíbrio químico são importantes na obtenção de produtos – processos Solvay; entender a importância da ingestão de iodo para a saúde; entender a importância de órgãos de fiscalização; refletir sobre saberes escolares podem fundamentar escolhas e atitudes na vida cotidiana
17ª semana 21/05 a 25/05/2018
Fechamento e avaliação, recuperação do 1° bimestre. Pesquisa Funções Inorgânicas.
DISCIPLINA: QUÍMICA – 3° SÉRIE CRONOGRAMA DE ATIVIDADES DO 2° SEMESTRE
12ª semana
SITUAÇÃO DE APRENDIZAGEM 1º – A BIOSFERA COMO FONTE DE MATERIAIS ÚTEIS AO SER HUMANO
Conteúdos e temas: materiais extraídos de recursos animais ou vegetais e de animais e vegetais fossilizados. Competências e habilidades: reconhecer e valorizar a biosfera como fonte de materiais úteis para o ser humano; conhecer alguns usos cotidianos e algumas aplicações industriais desses materiais.
Sugestão de estratégias de ensino: discussão em grupos desencadeada por associação de palavras.
Sugestão de recursos: artigos de jornais ou revistas.
Sugestão de avaliação: participação e envolvimento nas atividades desenvolvidas.
13ª semana
Situação de Aprendizagem 2 – SITUAÇÃO DE APRENDIZAGEM 2 COMPOSIÇÃO, PROCESSAMENTO E USOS DO PETRÓLEO, DO GÁS NATURAL E DO CARVÃO
Conteúdos e temas: processos de obtenção e purificação do petróleo, do gás natural e do carvão mineral e seus derivados; utilização e importância econômica desses materiais; estrutura e nomenclatura de hidrocarbonetos; isomeria em cadeias abertas e fechadas.
Competências e habilidades: interpretar e analisar textos referentes à descoberta e à exploração de jazida de petróleo e gás natural; compreender os processos de transformação do petróleo, do carvão mineral e do gás natural em materiais e substâncias utilizados no sistema produtivo – refino do petróleo, destilação seca do carvão mineral e purificação do gás natural; estabelecer relações entre a temperatura de ebulição, a estrutura e a nomenclatura de hidrocarbonetos por meio de dados apresentados em tabelas; construir estruturas de hidrocarbonetos com base na fórmula molecular para compreender o conceito de isomeria; analisar fluxograma dos produtos obtidos do carvão mineral e reconhecer suas diversas aplicações.
Sugestão de estratégias de ensino: leitura e interpretação de textos, aulas expositivo-dialogadas e pesquisas. Sugestão de recursos: textos, artigos e livros.
Sugestão de avaliação: participação, consistência das informações pesquisadas e respostas aos questionários.
14ª semana
Fechamento e avaliação, recuperação do 3° bimestre. Pesquisa Funções Inorgânicas.
15ª semana
SITUAÇÃO DE APRENDIZAGEM 3 COMPOSIÇÃO, PROCESSAMENTO E USOS DA BIOMASSA
Conteúdos e temas: processos de transformação, usos sociais da biomassa e questões ambientais. Competências e habilidades: reconhecer a biomassa (e exemplos de materiais a ela pertencentes) como recurso alternativo ao uso de combustíveis fósseis; valorizar conhecimentos químicos como 41 Química – 3a série – Volume 2 instrumentos para a busca de alternativas energéticas; avaliar a biomassa como fonte de energia alternativa; aplicar conceitos de nomenclatura orgânica para melhor entender as informações relativas à biomassa; desenvolver atitudes como saber ouvir, dialogar e argumentar. Sugestão de estratégias de ensino: aulas expositivo-dialogadas; levantamento de ideias que os alunos já possuem sobre biomassa; pesquisa orientada por perguntas; discussão de informações pesquisadas em roda de conversa. Sugestão de recursos: livros, material de outras séries, jornais, revistas e internet. Sugestão de avaliação: apresentação do material de pesquisa solicitado; apresentação dos resultados das pesquisas; síntese das informações pesquisadas; participação.
16ª semana
SITUAÇÃO DE APRENDIZAGEM 4 A BIOSFERA COMO FONTE DE ALIMENTOS PARA O SER HUMANO
Conteúdos e temas: componentes nutricionais dos alimentos; propriedades e funções orgânicas encontradas em carboidratos, lipídios e proteínas; nutrição e saúde. Competências e habilidades: reconhecer as funções orgânicas presentes nos diferentes grupos de alimentos; reconhecer polímeros, assim como os monômeros que os compõem. Sugestão de estratégias de ensino: retomada da análise de rótulos de alimentos realizada em Biologia, focalizando os valores energéticos de cada componente e sua relação com as respectivas estruturas; discussões relacionadas às funções de cada grupo de alimentos na manutenção da vida. Sugestão de recursos: questões; observação de estruturas; livro didático. Sugestão de avaliação: participação em aula; realização das atividades; respostas aos exercícios.
SITUAÇÃO DE APRENDIZAGEM 4 A BIOSFERA COMO FONTE DE ALIMENTOS PARA O SER HUMANO
Conteúdos e temas: componentes nutricionais dos alimentos; propriedades e funções orgânicas encontradas em carboidratos, lipídios e proteínas; nutrição e saúde. Competências e habilidades: reconhecer as funções orgânicas presentes nos diferentes grupos de alimentos; reconhecer polímeros, assim como os monômeros que os compõem. Sugestão de estratégias de ensino: retomada da análise de rótulos de alimentos realizada em Biologia, focalizando os valores energéticos de cada componente e sua relação com as respectivas estruturas; discussões relacionadas às funções de cada grupo de alimentos na manutenção da vida. Sugestão de recursos: questões; observação de estruturas; livro didático. Sugestão de avaliação: participação em aula; realização das atividades; respostas aos exercícios.
Aproveite para conferir videoaulas relacionadas ao assunto:
Estudo do Carbono
Química Orgânica
 A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicas
A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicasA Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório.
Entretanto, provou-se que o homem conseguia sim sintetizar compostos orgânicos em laboratório, e então a definição de Química Orgânica mudou para:
“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.
Visto que o carbono é tetravalente, podendo realizar quatro ligações de diferentes maneiras, com átomos de outros elementos ou com átomos do próprio carbono, existem milhões de seus compostos. Uma quantidade muito superior do que a de compostos inorgânicos conhecidos atualmente.
Tais compostos são agrupados em diferentes funções que apresentam propriedades químicas semelhantes, tais como os hidrocarbonetos, os álcoois, as cetonas, os aldeídos, os ácidos carboxílicos, os ésteres, os éteres, as aminas, as amidas, entre outros, como ocorre o fenômeno da isomeria em muitas dessas substâncias e o que são os polímeros naturais e artificiais que formam os plásticos tão comuns em nosso cotidiano.
Composição: o C é o principal elemento, incluem também o H, N, O, S, P e ainda os halogênios.
Características: em geral os compostos orgânicos são covalentes apolares. A presença de um elemento diferente do C e H promove certa polaridade na molécula.
H H
Ex.: H – C – H H – C – OH
H H
Apolar Polar
CARACTERÍSTICAS GERAIS
Ponto de fusão e ebulição: inferiores aos compostos inorgânicos, a maioria apresenta instabilidade térmica.
Isomeria: compostos com a mesma fórmula molecular.
Solubilidade: os apolares pouco solúveis em água, os polares solúveis, a exemplo do álcool e açúcar.
Combustibilidade: em geral são combustíveis.
Encadeamento: em função da tetravalência do C tendem a formar estruturas denominadas cadeias carbônicas.
Velocidade de reação: pouco reativos, dependem de ativadores (luz, calor, pressão, catalisadores, etc.).
Postulados de Couper – Kekulé
Tais postulados foram propostos no século XIX e são resultantes do trabalho de diversos cientistas, em especial, do químico Archibald Scott Couper e, claro, do próprio Kekulé. Assim, é comum também denomina-los Postulados de Couper-Kekulé.
Postulados do Carbono
Por que é importante estudar a fundo o Carbono? Este elemento é a unidade fundamental dos compostos orgânicos, tudo se explica por suas propriedades únicas.
O comportamento químico do carbono começou a ser explicado através dos estudos de dois cientistas do século XIX, Archibald Scott Couper (1831-1892) e Friedrich August Kekulé (1829-1896). Estes estudiosos deram nome aos postulados de “Couper-Kekulé”, vamos conhecer agora as propriedades do carbono detalhadas por este conceito:
1° postulado: O átomo de carbono é tetravalente
A tetravalência do carbono é sua propriedade de formar quatro ligações covalentes, ou seja, ele disponibiliza quatro elétrons ligantes. Isso porque em sua camada de valência o átomo de carbono possui 4 elétrons livres.
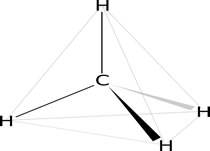
Metano: molécula formada pela ligação de 4 átomos de Hidrogênio (H) a 1 átomo de carbono (C).
2° postulado: As quatro unidades de valência do carbono são iguais entre si.
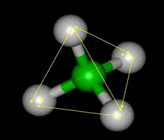
O Fluorometano é um exemplo desta propriedade, só existe um composto com este nome, ele é formado pela substituição de um hidrogênio da molécula de Metano por um átomo de Flúor (F). O Flúor poderá substituir qualquer H da molécula que receberá a mesma nomenclatura, repare na ilustração abaixo:
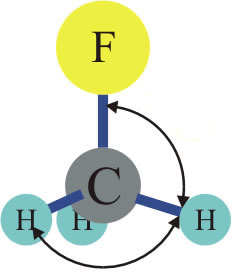
Qualquer posição ocupada pelo átomo de Flúor dará origem ao Fluorometano.
3° postulado: Propriedade de encadeamento – capacidade que átomos de um mesmo elemento têm de formar cadeias moleculares.
.jpg)
Átomos de carbono ligam-se diretamente entre si, formando estruturas denominadas cadeias carbônicas. A variedade de compostos orgânicos existentes na natureza se deve a esta propriedade do Carbono de formar cadeias. O composto acima (decano) é formado por 10 átomos de C interligados.
O carbono não é o único elemento químico que pode formar encadeamentos: alguns outros elementos como o enxofre e o nitrogênio, por exemplo, também apresentam essa característica. No entanto, somente o carbono pode constituir cadeias tão diversificadas, extensas e quimicamente estáveis.
A tetravalência do carbono, sua capacidade de se ligar com vários tipos de elementos químicos e de formar cadeias carbônicas são as propriedades responsáveis pelo enorme número de compostos orgânicos já conhecidos. Por isso, a Química Orgânica é definida como a área da Química que trata dos compostos de carbono com características específicas.
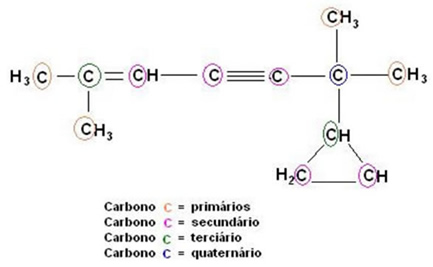
Classificação do Carbono
A classificação do carbono é baseada na quantidade dos demais átomos de carbono ligado a ele e também no tipo de ligação.
O carbono pode ser classificado seguindo vários critérios: um deles se baseia na quantidade dos demais átomos de carbono a ele ligados.
Carbono primário: ligado diretamente, no máximo, a 1 outro carbono;
Carbono secundário: ligado diretamente a 2 outros carbonos
Carbono terciário: ligado diretamente a 3 outros carbonos;
Carbono quaternário: ligado diretamente a 4 outros carbonos.
A outra classificação se refere aos tipos de ligação que unem os carbonos.
O carbono pode ser classificado em função das ligações que apresenta:
a) Carbono Saturado: apresenta somente ligações simples, chamadas de sigma (σ).
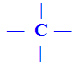
b) Carbono Insaturado: presença de duplas ligações, denominadas de pi (π). Ou ainda, carbono que apresenta ligação tripla.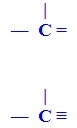
Classificação das cadeias carbônicas
As cadeias carbônicas podem ser classificadas de diversas maneiras:
Quanto à disposição dos átomos de carbono
Cadeia aberta, alifática ou acíclica: é composta pelo menos de duas extremidades e não apresenta ciclos na cadeia.
Cadeia fechada ou cíclica: não apresenta extremidades e os átomos fecham em pelo menos um ciclo.
As cadeias fechadas ou cíclicas ainda se dividem em dois grupos: aromáticas e não aromáticas.
Cadeias aromáticas: possuem pelo menos um anel aromático, que é um anel que contém ligações duplas alternadas. Podem ser ramificadas ou não.
As cadeias aromáticas, podem ainda, ser divididas entre mononucleares (um núcleo) ou polinucleares (mais de um núcleo). As polinucleares podem ser isoladas (núcleos não compartilham átomos) ou condensadas (núcleos compartilham átomos).
Cadeias não aromáticas ou alicíclicas: possuem uma cadeia fechada, porém que não tem as ligações duplas alternadas.
Cadeia normal ou linear: apresenta somente duas extremidades, sem ramificações.
Cadeia ramificada: apresenta no mínimo três extremidades, pois possuem ramificações.
Quanto ao tipo de ligação entre os átomos de carbono
Cadeia saturada: só possui ligações simples em sua estrutura.
Cadeia insaturada: possui pelo menos uma ligação dupla ou tripla em sua estrutura.
Quanto a natureza dos átomos que compõem a cadeia
Cadeia homogênea: possui apenas átomos de carbono na extensão da cadeia.
Note que a presença de um átomo diferente de carbono na ponta da cadeia não configura ela como heterogênea.
Cadeia heterogênea: possui a presença de heteroátomos.
Em algumas situações, as cadeias podem ser abertas e fechadas simultaneamente, devido a presença de uma ramificação. Nestes casos, chamamos estas cadeias de mistas.
Em geral, para se classificar uma cadeia, segue-se o seguinte raciocínio:
Classificação das cadeias carbônicas fechadas
A classificação das cadeias carbônicas fechadas utiliza como referência a presença de núcleo benzênico, ligações pi ou heteroátomos.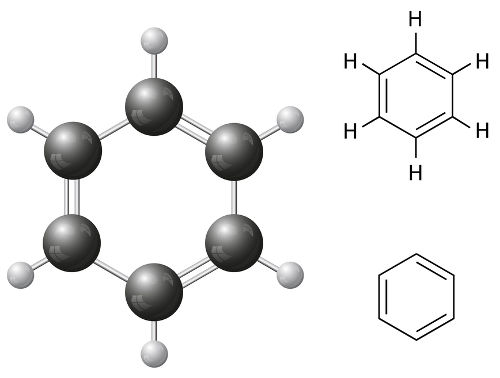
O benzeno é um dos principais exemplos de substância com cadeia carbônica fechada
A classificação das cadeias carbônicas fechadas é um importante tópico estudado na química orgânica, pois, a partir desse conhecimento, é possível construir a fórmula estrutural de um composto orgânico, como ciclenos, alcoóis cíclicos, aromáticos, cetonascíclicas, éteres cíclicos, etc.
Para realizar a classificação das cadeias carbônicas fechadas, iniciamos pela divisão em dois grandes grupos:
- Cadeia carbônica fechada aromática;
- Cadeia carbônica fechada não aromática.
Classificação das cadeias carbônicas fechadas aromáticas
As cadeias fechadas aromáticas apresentam como principal característica a presença de um ciclo, que contém:
- Seis átomos de carbono;
- Seis átomos de hidrogênio;
- Um átomo de hidrogênio em cada carbono;
- 3 ligações duplas;
- 3 ligações simples;
- Ligações simples e duplas alternadas entre si.
Esse ciclo, com essas características, tem o nome oficial de benzeno. Um ponto fundamental é que ocorre no benzeno um fenômeno denominado de ressonância, no qual as ligações duplas trocam de posição de forma ininterrupta, alterando constantemente sua posição. Por essa razão, é comum simbolizar as três duplas apenas por um círculo, que representa a ressonância.
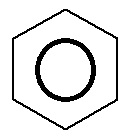
Fórmula estrutural do benzênico com o anel
a) Aromáticas mononucleares
São as cadeias aromáticas que apresentam apenas um benzeno, que está ligado a outro elemento (por exemplo, o cloro), grupo substituinte (como o radical metil, CH3) ou um grupo funcional (como a carboxila).
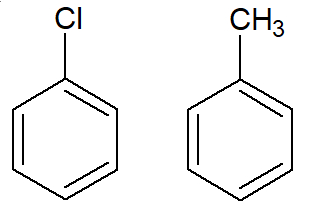
Exemplos de aromáticos mononucleares
b) Aromáticas polinucleares
- Com núcleos isolados
Nesse tipo de cadeia carbônica aromática, há a presença de dois ou mais núcleos benzênicos, porém separados por um átomo de um elemento (por exemplo, um oxigênio) ou grupo funcional (por exemplo, a carbonila de uma cetona).
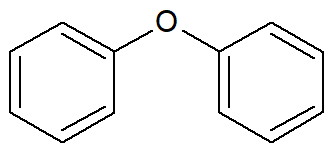
Fórmula estrutural de um aromático isolado por um elemento químico
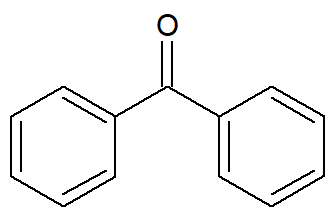
Fórmula estrutural de um aromático isolado por um grupo funcional de cetona
- Com núcleos condensados
Nesse tipo de cadeia carbônica fechada aromática, temos a presença de dois ou mais núcleos benzênicos, unidos entre si, ou seja, existem carbonos e ligações em comum nas estruturas.
As cadeias aromáticas podem ser classificadas de acordo com o número de anéis aromáticos:
– mononuclear: quando possui apenas um núcleo (anel aromático)
– polinuclear: quando possui vários anéis aromáticos.
Os aromáticos polinucleares podem ser classificados em:
– polinucleares isolados: quando os anéis não possuem átomo de carbono em comum.
– polinuclear condensado: quando os anéis possuem átomos de carbono em comum.
– saturada: cadeia que possui apenas ligações simples entre os átomos.
– insaturada: cadeia que possui uma dupla ligação entre carbonos.
Podem ser classificadas de acordo com a presença ou não de um heteroátomo:
– homogênea ou homocíclicas: possuem somente átomos de carbonos ligados entre si.
– heterogênea ou heterocíclica: possuem um heteroátomo entre átomos de carbono.
Cadeias mistas
As cadeias carbônicas mistas são abertas e também fechadas.
REPRESENTAÇÃO DAS CADEIAS CARBÔNICAS
Até agora as cadeias carbônicas foram representadas através de formas chamadas de fórmulas estruturais planas. Esse tipo de fórmula mostra todas as ligações, simbolizadas pelos traços, envolvidas nas cadeias carbônicas. Porém, visto que muitas dessas cadeias podem ser longas e complexas, é comum simplificar a fórmula estrutural, condensando algumas ligações. É possível fazer isso através de dois modos. Veja cada um deles:
- Fórmula estrutural condensada: a primeira forma de simplificar uma cadeia carbônica é utilizar índices, isto é, números que indicam a quantidade de átomos de hidrogênio que se ligam ao carbono. Exemplo:
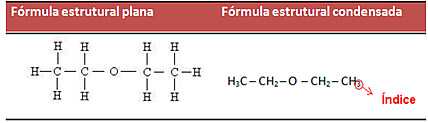
Isso também pode ser feito de forma ainda mais simplificada, utilizando índices para mostrar a quantidade de carbonos na cadeia. Veja como a fórmula mostrada anteriormente fica:
H5 C2 ̶ O ̶ C2H5
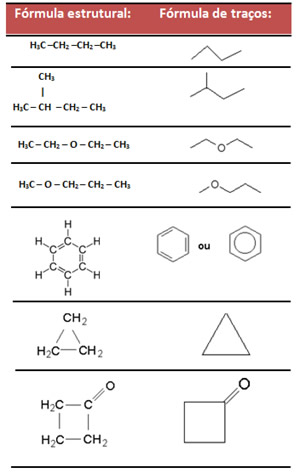
- Fórmula de traços: essa fórmula representa as ligações entre carbonos, usando traços. As pontas, bem como as pontas das inflexões, correspondem a átomos de carbono.
Exemplos:
Lista de Exercícios – cadeias carbônicas
Classifique as cadeias existentes em cada uma das estruturas a seguir e determine o número de carbonos primários, secundários, terciários e quaternários, e escreva suas fórmulas moleculares :
1 – (Padre Anchieta SP) A substância de fórmula CH3–O–CH2–CH3 tem cadeia carbônica:
a) acíclica, homogênea e normal.
b) cíclica, heterogênea e ramificada.
c) cíclica, homogênea e saturada.
d) acíclica, insaturada e heterogênea.
e) acíclica, saturada e heterogênea.
2 – . (Unifor CE) A acrilonitrila, H2C=CH–CN, matéria-prima usada na obtenção de fibras têxteis, tem cadeia carbônica:
a) acíclica e ramificada.
b) cíclica e insaturada.
c) cíclica e ramificada.
d) aberta e homogênea.
e) aberta e saturada.
3 – (UFRN) A cadeia carbônica acíclica, ramificada, homogênea e insaturada é:
![]()


![]()

4- (MACK SP) O hidrocarboneto, que apresenta a menor cadeia carbônica aberta, saturada e ramificada, tem fórmula molecular:
a) CH4
b) C4H8
c) C5H8
d) C4H10
e) C2H4
5 – (ITE SP) O composto orgânico, de fórmula plana, possui:

a) 5 carbonos primários, 3 carbonos secundários, 1 carbono terciário e 2 carbonos quaternários.
b) 3 carbonos primários, 3 carbonos secundários, 1 carbono terciário e 1 carbono quaternário.
c) 5 carbonos primários, 1 carbono secundário, 1 carbono terciário e 1 carbono quaternário.
d) 4 carbonos primários, 1 carbono secundário, 2 carbonos terciários e 1 carbono quaternário.
6 – (MACK SP) O composto apresenta:

a) cadeia carbônica insaturada.
b) somente carbonos primários.
c) um carbono quaternário.
d) três carbonos primários e um terciário.
e) cadeia carbônica heterogênea.
7 – (UFJF MG) Classificar a cadeia da molécula 3-metil 1-penteno.
a) cíclica, ramificada, saturada, homogênea;
b) acíclica, normal, insaturada, heterogênea;
c) acíclica, ramificada, insaturada, homogênea;
d) cíclica, ramificada, saturada, homogênea;
e) acíclica, ramificada, saturada, homogênea;
8- (UEL PR) Dentre os componentes do cigarro, encontram-se a nicotina que interfere no fluxo de informações entre as células, a amônia que provoca irritação nos olhos e o alcatrão, formado pela mistura de compostos como o benzopireno, o crizeno e o antraceno, todos com potencial cancerígeno.
Sobre o benzopireno, cuja estrutura química é apresentada a seguir, é correto afirmar que a molécula é formada por:

a) Cadeias aromáticas com núcleo benzênico.
b) Arranjo de cadeias carbônicas acíclicas.
c) Cadeias alicíclicas de ligações saturadas.
d) Cadeias carbônicas heterocíclicas.
e) Arranjo de anéis de ciclohexano.
9. O náilon é um polímero de condensação, mais especificamente da classe das poliamidas, que são polímeros formados pela condensação de um diácido carboxílico com uma diamida. Uma das variedades desse polímero pode ser obtida por meio de uma matéria-prima denominada de caprolactana, cuja fórmula estrutural é:
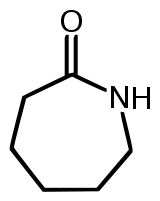
Fórmula da caprolactana
Analisando essa cadeia, podemos classificá-la em:
a) Fechada, insaturada, heterogênea, mononuclear.
b) Alicíclica, insaturada, heterogênea, mononuclear.
c) Fechada alicíclica, saturada, heterogênea, mononuclear.
d) Fechada alicíclica, insaturada, homogênea, mononuclear.
e) Fechada, insaturada, homogênea, mononuclear.
10. Considere as seguintes substâncias, suas fórmulas estruturais e aplicações:
1. Cl — CH2 — S — CH2 — CH2 — Cl→ gás mostarda
2. HS — CH2 — CH — CH2 — OH → antídoto no envenenamento por arsênio
|
SH
CH3
|
3. H3C — CH — CH2 — CH2 — SH → cheiro desagradável do gambá
4..jpg) → anestésico
→ anestésico
5. 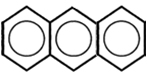 → Substância presente na fumaça do cigarro
→ Substância presente na fumaça do cigarro
Molécula de antraceno
O
||
6. H3C — CH2 — CH2 — C — O — CH2 — CH3 → essência de abacaxi
Qual(is) dentre essas cadeias carbônicas pode(m) ser classificada (s) como uma cadeia alifática, normal, saturada e heterogênea?
a) 1, 2, 3, 6.
b) Todas.
c) 4,5.
d) 1 e 6.
e) Somente 1.
11. UFAM-PSC) O pau-rosa, típico da região amazônica, é uma rica fonte natural do óleo essencial conhecido por linalol, o qual também pode ser isolado do óleo de alfazema. Esse óleo apresenta a seguinte fórmula estrutural:
OH
|
H3C — C = CH — CH2 — CH2 — C — CH = CH2
| |
CH3 CH3
Sua cadeia carbônica deve ser classificada como:
a) acíclica, ramificada, saturada e heterogênea.
b) acíclica, normal, insaturada e homogênea.
c) alicíclica, ramificada, insaturada e homogênea.
d) acíclica, ramificada, insaturada e homogênea.
e) alicíclica, normal, saturada e heterogênea.
12. (PUC-RS) O ácido etilenodiaminotetracético, conhecido como EDTA, utilizado como antioxidante em margarinas, de fórmula
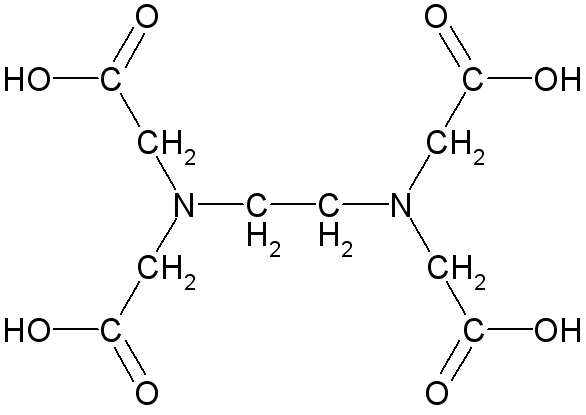
Fórmula do EDTA (ácido etilenodiaminotetracético)
Apresenta cadeia carbônica
a) acíclica, insaturada, homogênea.
b) acíclica, saturada, heterogênea.
c) acíclica, saturada, homogênea.
d) cíclica, saturada, heterogênea.
e) cíclica, insaturada, homogênea.
AULA 5
HIDROCARBONETOS
Muitos estudantes têm medo da Química e, quando escutam a palavra “hidrocarbonetos“, já ficam preocupados. Na verdade, você não tem motivo para se sentir assim. Apesar da quantidade de classificações ser grande, é fácil entender a diferença entre cada um deles. O mais importante é estudar com atenção os conceitos, para não se confundir na hora de prova.
O que são hidrocarbonetos?
Estudamos os hidrocarbonetos dentro da química orgânica.
Os hidrocarbonetos são compostos químicos constituídos primariamente por átomos de hidrogênio e carbono, por meio de ligações covalentes. Além desses dois elementos, também podem haver átomos de nitrogênio, oxigênio, fósforo e enxofre na composição, formando grupos especiais.
Exemplos de hidrocarbonetos
Existem milhares de hidrocarbonetos. Alguns exemplos bem conhecidos são:
- o metano, ou gás natural, usado em veículos;
- o propano e o butano, usados em gás de cozinha;
- o octano, ou gasolina; o etanol, ou álcool etílico, presente em bebidas e perfumes, entre outros produtos;
- a propanona, ou acetona.
Classificação dos hidrocarbonetos
Apesar de todos os hidrocarbonetos compartilharem a mesma definição básica, alguns tipos apresentam características específicas e, assim, formam grupos diferentes. Vamos ver quais são esses grupos?
Alifáticos
Os hidrocarbonetos alifáticos são aqueles em que a cadeia de carbonos é aberta, ou acíclica.
Cíclicos
Os hidrocarbonetos cíclicos são aqueles em que a cadeia de carbonos tem uma formação cíclica. Isso quer dizer que não há “carbonos terminais”. Um hidrocarboneto pode ser cíclico e, ainda assim, ter um átomo de carbono fora do ciclo.
Saturados
Os hidrocarbonetos saturados são aqueles em que as ligações entre os átomos são simples.
Insaturados
Os hidrocarbonetos insaturados são aqueles em que há ligações duplas ou triplas entre os átomos.
Homogênea
Os hidrocarbonetos de cadeia homogênea são aqueles em que não há nenhum átomo diferente de carbono ou hidrogênio.
Heterogênea
Os hidrocarbonetos de cadeia heterogênea são aqueles em que há átomos de outros elementos.
Tipos de hidrocarbonetos
Agora que você já conhece a classificação dos hidrocarbonetos, vamos ainda mais a fundo. Você sabe quais são os principais tipos de hidrocarboneto? Aqui está uma lista com oito deles.
Alcanos
Os hidrocarbonetos alifáticos e saturados são chamados de alcanos.
Alcenos
Os hidrocarbonetos alifáticos e insaturados, que apresentam uma ligação dupla entre seus átomos de carbono, são chamados de alcenos.
Alcinos
Os hidrocarbonetos alifáticos e insaturados, que apresentam uma ligação tripla entre seus átomos de carbono, são chamados de alcinos.
Alcadienos
Os hidrocarbonetos alifáticos e insaturados, que apresentam duas ligações duplas entre seus átomos de carbono, são chamados de alcinos.
Ciclanos
Os hidrocarbonetos cíclicos e saturados são chamados de ciclanos.
Ciclenos
Os hidrocarbonetos cíclicos e insaturados, que apresentam uma ligação dupla entre seus átomos de carbono, são chamados de ciclenos.
Ciclinos
Os hidrocarbonetos cíclicos e insaturados, que apresentam uma ligação tripla entre seus átomos de carbono, são chamados de ciclinos.
Aromáticos
Os hidrocarbonetos cíclicos que são compostos por, no mínimo, um anel de benzeno são chamados de aromáticos. O anel de benzeno é o nome dado à estrutura C6H6 característica do benzeno.
Alguns compostos que não apresentam a estrutura do benzeno também são considerados aromáticos. Eles seguem a Regra de Hückel, segundo a qual o número de elétrons π (pi) é igual a 4n + 2, onde n = 0, 1 , 2, 3…
Nomenclatura de hidrocarbonetos
Para dar nome a uma molécula de hidrocarboneto, você precisa observar sua estrutura. Não deixe de conferir sobre os derivados dos hidrocarbonetos, ok?
Aqui vão os critérios utilizados para a nomenclatura.
Prefixo
O prefixo da nomenclatura está relacionado ao número de carbonos encontrados na cadeia principal da molécula. Os prefixos são:
- 1 carbono: MET
- 2 carbonos: ET
- 3 carbonos: PROP
- 4 carbonos: BUT
- 5 carbonos: PENT
- 6 carbonos: HEX
- 7 carbonos: HEPT
- 8 carbonos: OCT
- 9 carbonos: NON
- 10 carbonos: DEC
Infixo
O infixo da nomenclatura está relacionado ao tipo de ligação encontrada na molécula de hidrocarboneto. Os infixos são:
- Ligações simples apenas: AN
- 1 ligação dupla: EN
- 1 ligação tripla: IN
- 2 ligações duplas: DIEN
- 2 ligações triplas: DIIN
Sufixo
O sufixo é responsável por indicar a função orgânica. No caso dos hidrocarbonetos, o sufixo é sempre “o”.
Exercícios de hidrocarbonetos
A partir dos conceitos que você acabou de ver, que tal praticar com alguns exercícios de fixação sobre hidrocarbonetos? Verifique o quanto você lembra sobre esses compostos, tentando resolver os exercícios abaixo.
Exercício 1
A química orgânica estuda os compostos de carbono e, assim sendo, é importante saber as características básicas deste elemento. Uma das condições mais interessantes é que o carbono é tetravalente, o que significar dizer que:
- Pode formar cadeias com total de quatro outros átomos de carbono
- É capaz de formar ligações quádruplas estáveis
- É capaz de formar quatro ligações covalentes
- Possui um total de oito elétrons em sua camada de valência
Resposta
Letra c.
Exercício 2
Os hidrocarbonetos aromáticos são assim classificados de acordo com alguns critérios conhecidos como critérios de aromaticidade. Identifique entre as alternativas abaixo aquela que se relaciona de modo correto esses critérios.
- Qualquer composto cíclico que possui insaturações é chamado de aromático
- Compostos cíclicos planares que possuem elétrons pi (π) em número par e que seguem a regra de Hückel (4n + 2) π
- Compostos cíclicos que seguem a regra (4n + 2) π, onde n = 0, 1, 2, …
- Apenas o benzeno é classificado como hidrocarboneto cíclico aromático
Resposta
Letra b.

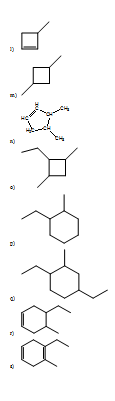
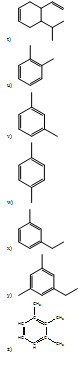

- 2-metil pentano
- 2,2,4-trimetil pentano
- 2,2,5-trimetil hexano
- 4-etil-2,2,3-trimetildecano
- 4-metil pent-1-eno
- 3-metil pent-1-eno
- 3-etil-3-propil heptano
- 2,6-dimetil-5-propil-octano
- 4-terc-butil-4-etil-2,2,3-trimetiloctano
- 4-etil-5-metil hex-2-eno
- 3-isopropil-4,6-dimetil oct-1-eno
- 4-etil-7-metil-5-propil-nonano
- 2, 3-dietil-2, 3-dimetil-hex-4-eno
- 4,4,6-trimetil oct-2-ino
- 2,2,5-trimetil-3-heptino
- 6-etil-2,2,7-trimetl oct-4-eno
- 5-secbutil-2,2,4,6-tetrametil octano
- 2-benzil-3-hexino
- 2-fenil-3-hexino
- 4,5-dimetil oct-2-ino
- 2-metil hex-3-eno
- 2,2,3-trimetil pentano
- 4-fenil but-1-eno
- 4-fenil-3-metil pent-1-eno
- 4-benzil-5-etil hept-2-ino
2,6-difenil hept-
17ª semana
SITUAÇÃO DE APRENDIZAGEM 5 DESEQUILÍBRIOS AMBIENTAIS CAUSADOS PELA INTRODUÇÃO DE MATERIAIS NA ATMOSFERA
Conteúdos e temas: ciclos biogeoquímicos; regiões da atmosfera e suas características; poluentes atmosféricos e tempo de residência – seus efeitos sobre o ambiente e sobre os seres vivos; transformações químicas na atmosfera.
Competências e habilidades: buscar, selecionar e organizar informações em fontes diversas sobre problemas de poluição; aplicar conhecimentos sobre fontes de emissão de gases poluentes e problemas por eles causados para promover ações solidárias.
Sugestão de estratégias de ensino: pesquisa de informações em periódicos, livros didáticos e paradidáticos; aulas expositivo-dialogadas.
Sugestão de recursos: livros didáticos e paradidáticos; materiais de outras séries. Sugestão de avaliação: apresentação de tarefas; participação nas aulas.
18ª semana
SITUAÇÃO DE APRENDIZAGEM 6 POLUIÇÃO DAS ÁGUAS: CONHECENDO PARA SABER ANALISAR E AGIR
Conteúdos e temas: poluição das águas; tratamento de esgotos domésticos; DBO; fosfatos em águas; ciclo da água. Competências e habilidades: reconhecer como as atividades humanas podem contribuir para a poluição das águas; reconhecer a importância da coleta e do tratamento de esgotos para a qualidade das águas; avaliar as consequências do uso de materiais que introduzem fosfato nas águas; buscar informações, interpretá-las e tirar suas próprias conclusões sobre aspectos da poluição das águas. Sugestão de estratégias de ensino: aulas expositivo-dialogadas; trabalho em grupo; elaboração de painéis.
Sugestão de recursos: textos; pesquisa bibliográfica. Sugestão de avaliação: respostas às questões; elaboração de texto
19ª semana
Fechamento e avaliação, recuperação do 4° bimestre. Pesquisa Funções Inorgânicas.



.jpg)