Aula 1.
Acordo Pedagógico. Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania.
“Amarás ao teu próximo como a ti mesmo”. Respeito Mútuo é o principal compromisso ético que todo ser humano deve assumir é o de tratar as pessoas como pessoas, procurando entender o ponto de vista do outro mesmo que não esteja de acordo com seu princípios e teorias.
Nosso intuito é ajudar crianças e adolescentes a aprenderem a aprender, a buscarem o desenvolvimento a serem protagonistas da própria aprendizagem como ser integral e vislumbrarem suas potencialidades de ação social.
Não seja vítima da sua própria história! Não espere que alguém faça por você aquilo que só você pode fazer; escrever a sua história. Não seja manipulado por discursos políticos que promovem o coitadíssimo e por isso merecem uma recompensado Estado. Nossa recompensa é o fruto que colhemos. A colheita é consequência do que plantamos. Nada funciona de forma diferente, se você plantar e perseverar, você vai colher.
O estudo da Ciência no Ensino Médio também tem como objetivo prepara-lo para o mundo de trabalho e o exercício da cidadania, da ética, da prática da autonomia intelectual e do pensamento crítico; Isto quer dizer que esta fase da escolaridade tem, entre outras funções a de torná-lo apto a planejar, executar e avaliar ações de intervenção em sua realidade, que é a escola, o trabalho ou outras circunstâncias relevantes da sua vida.
O QUE PRECISO FAZER?
Fazer os trabalhos ou pesquisas sempre no caderno.Trazer a apostila do aluno em todas as aulas. Ler o texto em casa.
A leitura do texto é um dos recursos na construção de significados atribuídos a determinado objeto de ensino. Pretende-se utiliza-lo como desencadeadora é motivadora para a aprendizagem das transformações químicas.
Outra coisa interessante a se fazer é consultar um dicionário sempre que escutar ou ler uma palavra que você não tenha familiaridade ou não tenha certeza do seu significado. Assim, além de aumentar seu vocabulário, você conseguirá uma correta interpretação de sua leitura.
Tentar responder às Questões durante a semana, Assistir vídeo aulas. Na sala de aula faremos discussão do texto e responder as questões do texto, se necessário tirar as dúvidas.
ESTRATÉGIAS
Desenvolve aulas a partir de um levantamento prévio do conhecimento dos alunos, solicita pesquisas sobre o tema para introduzir o conteúdo utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apoia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros.
RECURSOS
Conteúdos retirados de livros didáticos, apostilas, pesquisas, vídeos, exemplos e experimentos.Análise de situações do cotidiano e suas relações com os conteúdos trabalhados.Livro Didático (Química na abordagem do cotidiano), Caderno do aluno.
AVALIAÇÃO
• Todas as atividades desenvolvidas pelos estudantes serão avaliadas no processo de aprendizagem. Aula dada aula avaliada!
• 5,0 pontos (Avaliação atitudinal): responsabilidade, pontualidade, participação em aula, tarefas de casa, comprometimento, empenho em aprender, respeito e tolerância às limitações dos colegas, disciplina, cooperação, frequência, caderno, apostila, participação em projetos.
• 3,0 pontos (Avaliação conceitual): exercícios de fixação e prova.
• 2,0 pontos Experimentos, (Pesquisas ou trabalhos:serão feitos no caderno avaliadas considerando os seguintes critérios: Tema; Resumo; Conclusão; Organização; Bibliografia; Apresentação.
RECUPERAÇÕES DA APRENDIZAGEM
O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma
-2019 será um ano de transição, estudos e testes;
– O currículo paulista ainda não foi aprovado, não haverá material de transição;
– Não renovaram os direitos autorais dos cadernos do professor e aluno, enquanto isso é para usar o livro didático, virá um material de transição, estão separando dos cadernos de apoio o que não tem direito autoral, secretário quer a construção do material com a rede;
-kits escolares chegarão até o final de março;
– a AAP será mantida mas a licitação só iniciou esse ano, ADE vai atrasar;
DISCIPLINA: QUÍMICA – 1° SÉRIE
CIÊNCIAS DA NATUREZA
INTRODUÇÃO
Ciências da Natureza, abrange grande parte de tudo que conhecemos por mundo. Você pode não se dar conta, mas tem muita ciência no nosso dia-a-dia. Esses conhecimentos estão divididos em três grandes grupos:
– Química, é uma ciência que surgiu da curiosidade humana em torno da composição de todas as coisas e do funcionamento do mundo que nos cerca. Atualmente, se dedica ao estudo da matéria, suas propriedades, as reações e as transformações, as energias envolvidas nesses processos.
Quando o nosso cérebro processa milhões de informações para comandar nossos movimentos, nossas emoções ou nossas ações, o que está ocorrendo é química.
A química está presente em todos os seres vivos. O corpo humano, por exemplo, é uma grande usina química. Reações químicas ocorrem a cada segundo para que o ser humano possa continuar vivo. Quando não há mais química, não há mais vida.
O que sabemos, no entanto, é que, sem a química, a civilização não teria atingido o atual estágio científico e tecnológico que permite ao homem sondar as fronteiras do universo, deslocar-se à velocidade do som, produzir alimentos em pleno deserto, tornar potável a água do mar, desenvolver medicamentos para doenças antes consideradas incuráveis e multiplicar bens e produtos cujo acesso era restrito a poucos privilegiados, desbravar novos Horizontes de Manipulação dos mesmos pelo homem, a fim de melhorar nossa vida e facilitar nossa evolução como Espécie. Tudo isso porque QUÍMICA É VIDA.
Afinal, não é estimulante saber que na produção de um simples computador doméstico há mais tecnologia reunida do que toda a tecnologia necessária para colocar o ser humano pela primeira vez na lua.
“A NECESSIDADE FAZ A HABILIDADE.” Talvez nenhum outro ditado explique tão bem nossa posição privilegiada como espécie dominante do nosso planeta. O conhecimento acumulado pelo ser humano e seus antepassados, 6,5 milhões de anos serviu inicialmente para alimentar, aquecer e proteger; mais tarde, para planejar, construir e prever.
Em todo este caminho aprendemos por imitação, por aquisição de conhecimentos transmitidos oralmente ou não por tentativa e erro, e essa jornada moldou a maneira de como fazemos ciência hoje.
Hoje sabemos que a ciência não é meramente um conjunto de conhecimentos catalogados como as artes liberais, porque ciência não se faz com respostas mas com perguntas, e para isso é preciso “sacudir” um pouco os conhecimentos confrontar o que se sabe com fatos novos, questionar. Segundo o físico Wener Heisenberg, o objetivo da ciência é antes de qualquer coisa, articular o ser humano e a natureza.
– Biologia, estuda os seres vivos até a ecologia e sustentabilidade;
– Física, que estuda a forma que o mundo ou o próprio Universo funcionam, desde o conceito de velocidade até as missões a marte e tal.
TEMAS PARA PESQUISAS:
TEMA 1- CONSTITUIÇÃO DA MATÉRIA TEMA
TEMA 2- PROPRIEDADES DA MATÉRIA
TEMA 3 – TRANSFORMAÇÃO FÍSICA E QUÍMICA
TEMA 4 – PROPRIEDADES DAS SUBSTÂNCIAS QUÍMICAS
TEMA 5 – TIPOS DE MISTURA
TEMA 6 – SEPARAÇÃO DE MISTURAS
TEMA 7 – PRODUÇÃO DO ÁLCOOL COMBUSTÍVEL E DO FERRO·
TEMA 8- ESTRUTURA DA MATÉRIA SIMBOLOGIA QUÍMICA
TEMA 9 – TABELA PERIÓDICA-
TEMA 10 – REAÇÕES DE COMBUSTÃO
Estes temas são para pesquisar, fazer o resumo e conclusão das idéias principais, no caderno em folha separada, colocar cabeçalho e fonte. Esta atividade é para fixação e compreensão dos conceitos para que seja possível a avaliação do conhecimento adquirido ao longo do estudo do tema.
Bons estudos!!!
Química Introdução


Historicamente, o homem primitivo começa a perceber as transformações químicas com o domínio do fogo. Naturalmente observou que a madeira ao ser queimada se transformava em cinzas, que as rochas do solo chegavam a se fundir, tomando uma aparência mais resistente. Com o domínio de produzir o fogo o homem primitivo passou a tirar vantagens, afugentando as feras, não tendo medo da escuridão e também, nas regiões mais frias as noites passaram a ser mais quentes (devido ao calor liberado pela combustão). Nota-se, que esse conhecimento proporciona mais segurança e gera um crescimento da espécie humana devido a melhor condição de vida. A utilização do fogo trouxe vários benefícios sendo, um deles, o cozimento dos alimentos diminuindo a contaminação por bactérias que eram responsáveis por muitas doenças da época primitiva. Essas mudanças proporcionaram melhores condições de vida, além do crescimento populacional da época.Com o domínio de produzir o fogo o homem primitivo passou a tirar vantagens, afugentando as feras, não tendo medo da escuridão e também, nas regiões mais frias as noites passaram a ser mais quentes (devido ao calor liberado pela combustão).
Benefícios da utilização do fogo

Mais segurança. O cozimento dos alimentos diminuiu a contaminação por bactérias que eram responsáveis por muitas doenças da época primitiva.Melhorou a condição de vida. Maior crescimento populacional da época.

Os recipientes de barro (argila) tiveram transformação ao serem levados ao fogo, adquirindo uma resistência em sua superfície, beneficiando utensílios para o preparo dos alimentos.

O domínio dos recursos naturais, como as ligas metálicas (bronze, latão, aço, etc.) geram o conhecimento sobre a metalurgia e siderurgia, e assim outras áreas do conhecimento vão surgindo.

O desenvolvimento da civilização foi surgindo à medida que suas habilidades nas transformações da matéria foram sendo aperfeiçoadas, como: o vidro, as joias, as moedas, as cerâmicas e inevitavelmente as armas mais resistentes e eficazes. A liga de aço acelerou um profundo impacto da química sobre a sociedade. Assim, a força muscular foi sendo substituída por máquinas. Com meios de transporte melhores e maior produtividade das fábricas, o comércio e o mundo se transformam, simultaneamente.

Em casa, no trabalho, no lazer ou em qualquer lugar está ocorrendo transformações da matéria, como a situação de preparar um simples café, chá ou mesmo a dissolução de um suco em pó na água.

O fato de nós suarmos, respirarmos, digerirmos, pensarmos, raciocinarmos, ou seja, sobrevivermos nos leva a muita transformação química.
Fonte http://blogdequimicaeja.blogspot.com/2017/
Aula 2
TEMA 1- CONSTITUIÇÃO DA MATÉRIA TEMA

De que é composto o Universo? Essa pergunta é curiosa e ao mesmo tempo comum, afinal o que compõe as estrelas, a água, a terra, os seres humanos e tudo que os cerca? Tudo provém da matéria e energia e a matéria é constituída de átomos. Sobre o núcleo atômico sabe-se que é constituído de prótons e nêutrons, aliás, essa teoria existe desde o ano de 1932, já nessa época defendia-se a ideia do átomo ser indivisível e recebeu a denominação de partícula fundamental.
Foram necessários vários anos de estudo para se chegar a essa concepção de átomo, e atualmente se faz importante o conhecimento da teoria atômica para entender a tecnologia presente o tempo todo em nossas vidas como, por exemplo, aparelhos eletrodomésticos como o forno microondas, a televisão, esses aparelhos possuem seus princípios de funcionamento baseados no átomo.
A matéria é formada por pequeníssimas partículas que chamamos de átomos. Os átomos possuem a propriedade de se agregar com outros átomos e compor diferentes materiais, é simples! Quando um átomo se junta com outro átomo logo surgem as moléculas, e essas por sua vez podem se unir a outras moléculas dando origem a moléculas cada vez maiores, até que se chegue no produto final: a composição da matéria.
E é basicamente assim que é formado tudo que vemos ao nosso redor, e esse conceito vai mais além, faz parte da composição do que não temos contato, como as estrelas, a lua, o sol, enfim, o átomo compõe o Universo.
Todas as coisas que compõem o universo são constituídos de energia e matéria. A matéria e a energia caminham juntas, pois se não existisse matéria não existiria energia e, não existindo energia não teríamos a matéria.

Matéria – A matéria tem duas características fundamentais: possui massa e ocupa lugar no espaço. Lembre-se que “ocupar lugar no espaço” é sinônimo de dizermos “tem volume”. Assim, massa e volume são coisas que tudo que é material tem. A matéria é formada por pequeníssimas partículas que chamamos de átomos; essas partículas podem se unir e formar o que chamamos de moléculas.

– Terra, Fogo, Água, Ar.
Energia – Capacidade de realizar trabalho.Entende-se por trabalho o movimento da matéria contra uma força que se opõe ao seu movimento. Assim, tudo que tem capacidade de movimentar a matéria possui energia.
Algumas formas de energia são térmica, solar, eólica, sonora, energia mecânica, elétrica e química, cinética, potencial, magnética, nuclear.Todas as formas podem converter-se umas nas outras, no entanto, a energia total do sistema permanece sempre constante.Assim, massa e volume são coisas que tudo que é material tem.
Corpo – é qualquer porção limitada da matéria.
Para um melhor entendimento acompanhe o seguinte raciocínio:
O ouro é uma matéria, mas se ele é usado para se obter uma joia, esse produto será considerado um objeto. Assim também acontece com a madeira, é uma matéria que dá origem a diferentes objetos: cadeiras, mesas, etc.
Objeto – é uma porção limitada de matéria quer por sua forma especial ou por sua (utilidade).

Massa – é a quantidade de matéria que um corpo possui, sendo, portanto, constante em qualquer lugar da terra ou fora dela.
Peso – de um corpo é a força com que esse corpo é atraído (gravidade) para o centro da terra. Varia de acordo com o local em que o corpo se encontra. Por exemplo: A massa do homem na Terra ou na Lua tem o mesmo valor. O peso, no entanto, é seis vezes maior na terra do que na lua.Explica-se esse fenômeno pelo fato da gravidade terrestre ser 6 vezes superior à gravidade lunar. Obs: A palavra grama, empregada no sentido de “unidade de medida de massa de um corpo”, é um substantivo masculino. Assim 200 g, lê-se “duzentos gramas”
Propriedades gerais da Matéria
A matéria tem 8 propriedades gerais: inércia, massa, extensão, impenetrabilidade, compressibilidade, elasticidade, divisibilidade e descontinuidade. Saiba mais sobre cada uma delas!
A matéria tem 8 propriedades gerais, isto é, 8 características comuns a toda e qualquer porção de matéria: inércia, massa, extensão, impenetrabilidade, compressibilidade, elasticidade, divisibilidade e descontinuidade.
Conheça cada uma delas a seguir:
Inércia:A matéria conserva seu estado de repouso ou de movimento, a menos que uma força aja sobre ela. No jogo de sinuca, por exemplo, a bola só entra em movimento quando impulsionada pelo jogador, e demora algum tempo até parar de novo.
Massa: É uma propriedade relacionada com a quantidade de matéria e é medida geralmente em quilogramas. A massa é a medida da inércia. Quanto maior a massa de um corpo, maior a sua inércia. Massa e peso são duas coisas diferentes. A massa de um corpo pode ser medida em uma balança. O peso é uma força medida pelos dinamômetros.
Extensão: Toda matéria ocupa um lugar no espaço. Todo corpo tem extensão. Seu corpo, por exemplo, tem a extensão do espaço que você ocupa.
Impenetrabilidade: Duas porções de matéria não podem ocupar o mesmo lugar ao mesmo tempo. Comprove a impenetrabilidade da matéria: ponha água em um copo e marque o nível da água com esparadrapo. Em seguida, adicione 3 colheres de sal. Resultado: o nível da água subiu. Isto significa que duas porções de matéria (água e sal), não podem ocupar o mesmo lugar no espaço (interior do copo) ao mesmo tempo.
Compressibilidade:Quando a matéria está sofrendo a ação de uma força, seu volume diminui. Veja o caso do ar dentro da seringa: ele se comprime.
Elasticidade:A matéria volta ao volume e à forma iniciais quando cessa a compressão. No exemplo anterior, basta soltar o êmbolo da seringa que o ar volta ao volume e à forma iniciais.
Divisibilidade:A matéria pode ser dividida em partes cada vez menores. Quebre um pedaço de giz até reduzi-lo a pó. Quantas vezes você dividiu o giz?!
Descontinuidade:Toda matéria é descontínua, por mais compacta que pareça. Existem espaços entre uma molécula e outra e esses espaços podem ser maiores ou menores tornando a matéria mais ou menos dura.
Propriedades Específicas da Matéria
É importante ressaltar que analisando as propriedades especificas, é possível identificar uma substância desconhecida
- Propriedades organolépticas
- Propriedades químicas
- Propriedades funcionais
Organolépticas:
São aquelas que podem ser detectadas pelos órgãos dos sentidos:
Se em sua cozinha existirem dois potes sem identificação, um contendo sal e outro açúcar, você também os identifica pelo gosto salgado ou doce. Um recipiente com óleo diesel e outro com gasolina também conseguem ser identificados apenas pela sua aparência
cor, brilho, odor e sabor.
a) Cor: está relacionada com a luz que ele reflete quando iluminado pela luz branca, a matéria pode ser colorida ou incolor. Esta propriedade é percebida pela visão.
b) Brilho: a capacidade de uma substância de refletir luz é a que determina o seu brilho. Percebemos o brilho pela visão.
c) Sabor: uma substância pode ser insípida (sem sabor) ou sápida (com sabor). Esta propriedade é percebida pelo paladar.
Algumas substâncias são conhecidas pelo seu sabor característico.
- Ácidos comestíveis: ácido cítrico/ ácido acético (vinagre)
- Açucares: frutose e sacarose
- Amargo: quinino, boldo
- Adstringente: caju e banana verde (amarra a boca)
O sabor no entanto não pode ser usado pelos químicos para identificar substâncias desconhecidas, pois elas podem ser tóxicas e venenosas.
d) Odor: a matéria pode ser inodora (sem cheiro) ou odorífera (com cheiro). Esta propriedade é percebida pelo olfato.

Nunca devemos cheirar substâncias desconhecidas, pois muitas liberam vapores tóxicos que podem provocar náuseas, tonturas e mal estar geral
Físicas:
Entre as propriedades físicas encontram-se o ponto de fusão, o ponto de ebulição, densidade e o calor específico, mas vamos estudar outras duas propriedades:
•a) Densidade: é o resultado da divisão entre a quantidade de matéria (massa) e o seu volume. A densidade absoluta de um corpo é igual a m/v. Se a massa é medida em gramas e o volume em centímetros cúbicos, a densidade é obtida em gramas por centímetros cúbicos. Ex.: Qual a densidade de um corpo que tenha massa de 200 g e está ocupando um volume de 2000 cm cúbicos? É de 0.1 g/cm cúbico.
b) Dureza: é a resistência que a superfície de um material tem ao risco. Um material é considerado mais duro que o outro quando consegue riscar esse outro deixando um sulco. Para determinar a dureza dos materiais, usamos uma escala de 1 a 10. O valor um corresponde ao mineral menos duro que se conhece, o talco. O valor 10 é a dureza do diamante, o mineral mais duro que se conhece.
Propriedades químicas
São aquelas que se referem à capacidade de uma substância de sofrer transformações.
Por exemplo, a combustão é uma propriedade que a gasolina possui. Quando esta queima, sua composição química muda, transformando-se em novas substâncias. Além da combustão, outros exemplos de propriedades químicas são: oxidação, redução e reatividade.
Propriedades Funcionais da Matéria
São propriedades características de um grupo de substâncias que apresentam propriedades semelhantes. São propriedades que estão presentes em um determinado conjunto de substâncias. Dentre as propriedades funcionais da matéria podemos citar as FUNÇÕES INORGÂNICAS.
As funções inorgânicas apresentam um certo número de características semelhantes.Podemos citar quatro tipos de funções inorgânicas:
1 – ÁCIDOS: Todos os ácidos tem como características o sabor AZEDO.
CUIDADO: Esse conceito não serve de pretexto para você sair experimentando tudo que é acido para constatar seu sabor azedo. Alguns ácidos são extremamente tóxicos e causar lesões graves e até mesmo levar a morte. Portanto tenha muito cuidado. Fiquemos com as substâncias ácidas mais comuns como limão, laranja, abacaxi, maracujá, vinagre, suco de uva, etc. Constata-se que essas substâncias realmente tem sabor azedo, logo dizemos que são substâncias ácidas.
Há também as substâncias ácidas mais fortes, como é o caso dos ácidos usados em laboratóriosque são altamente tóxicos, ÁCIDO CLORÍDRICO ( HCl ) e o ÁCIDO SULFÚRICO ( H2SO4 ).
2- BASES OU HIDRÓXIDOS: As Bases ou Hidróxiodos tem como característica o sabor adstringente, ou seja é uma substância que retrai ou contrai os tecidos humanos. Podemos dizer que ao experimentarmos uma substância com caráter básico, temos aquela sensação de boca travada, como se estivéssemos comido um caqui verde ou uma banana verde.
CUIDADO: O mesmo conselho dado para os ácidos, também serve para as BASES, então não saia experimentando tudo por aí para ver se tem característica de BASE. Assim como os ácidos, existem algumas bases que são extremamente tóxicas podendo causar lesões gravíssimas e irreversíveis e até levar a morte. Um exemplo de substância com caráter de BASE ou HIDRÓXIDO que é letal se ingerido é o HIDRÓXDIO DE SÓDIO ( NaOH ), conhecido popularmente como SODA CAUSTICA.
Existe um exemplo de hidróxido que é usado como medicamento laxante e antiácido estomacal que é o chamado HIDRÓXIDO DE MAGNÉSIO ou popularmente conhecido como LEITE DE MAGNÉSIA.
3 – ÓXIDOS: São compostos formados por dois elementos ( São os chamados compostos BINÁRIOS ), sendo que o elemento OXIGÊNIO é um deles, e estará sempre à direita da fórmula. A seguir cito alguns exemplos de fórmulas de óxidos bem como seus nomes e aplicações:
– CO2, DIÓXIDO DE CARBONO, conhecido popularmente como gás carbônico. No estado sólido é chamado Gelo Sêco. Esse composto é o gás dos refrigerantes.
– CO, MONÓXIDO DE CARBONO. Gás venenoso que pode causar a morte. Esse gás se origina pela combustão imcompleta. Se inalado em grande quantidada, se liga a hemoglobina do sangue e impede a passagem de oxigênio para o cérebro, levando a morte em poucos minutos. É um dos gases responsáveis pelo efeito estufa.
– CaO, ÓXIDO DE CÁLCIO – Conhecido popularmente por CAL. Utilizada na fabricação da argamassa, na fabricação do vidro. A chamada CAL VIRGEM ou CAL viva é muito utilizada para se fazer doce de abóbora.
4 – SAIS: São compostos formados pela reação entre um ÁCIDO e uma BASE.
ÁCIDO + BASE = SAL + ÁGUA
EXEMPLOS DE ALGUNS TIPOS DE SAIS E SUAS APLICAÇÕES
NaCl, CLORETO DE SÓDIO, popularmente conhecido como sal de cozinha. Acho que não preciso citar suas aplicações, não é mesmo?
Cloreto de Sódio- NaCl- Sal de cozinha
FONTE: MATERIAL DE APOIO AO CURRÍCULO DO ESTADO DE SÃO PAULO: CADERNO DO PROFESSOR, QUÍMICA, ENSINO FUNDAMENTAL, ENSINO MÉDIO, 1ª SÉRIE. SÃO PAULO: SE, 2014
HTTP://BLOGDEQUIMICAEJA.BLOGSPOT.COM/2017/https://www.mundovestibular.com.br/articles/9303/1/Propriedades-gerais-da-Materia/Paacutegina1.html
Competências e habilidades: ler e compreender as informações referentes à constituição da matéria, bem como os fatores que nela influem.·
Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto.·
Recursos: Pesquisa – Constituição da matéria.
Avaliação: respostas às questões e participação na discussão do texto.
Aula 3
TEMA 2- PROPRIEDADES DA MATÉRIA
Para executar determinada atividade em casa ou no trabalho, você precisa escolher a ferramenta certa. Para varrer a casa, uma vassoura ajuda muito mais do que, por exemplo, um pincel ou uma escova de dentes. Isso porque a vassoura tem propriedades, como tamanho das cerdas e comprimento do cabo, mais adequadas à aplicação que se tem em mente.
Com as substâncias químicas, acontece o mesmo. Ao preparar uma tinta para pintar paredes, por exemplo, um químico precisa escolher substâncias com propriedades indicadas a essa aplicação, como cor, odor, viscosidade e tempo de secagem. Portanto, as escolhas que você faz dependem das propriedades (químicas e físicas) que as substâncias possuem.
São essas propriedades que caracterizam as substâncias, ou seja, que permitem diferenciá-las e identificá-las. Da mesma maneira que você distingue uma pessoa a distância por suas características físicas, como altura, cor dos cabelos etc., pode-se identificar uma substância conhecendo suas propriedades químicas e físicas. Nenhuma substância tem o mesmo conjunto de propriedades de outra. Na Química, três propriedades físicas se destacam: a temperatura de fusão,a temperatura de ebulição e a densidade.
Temperaturas de fusão e de ebulição
Você já estudou, no Ensino Fundamental, que as substâncias podem se apre- sentar em três estados físicos: o sólido, como o sal de cozinha; o líquido, como o álcool; ou o gasoso, como o gás oxigênio. Em nosso planeta a água é encontrada nesses três estados físicos; além disso, essa substância passa de um estado físico para outro naturalmente, isto é, sem a intervenção direta dos seres humanos.
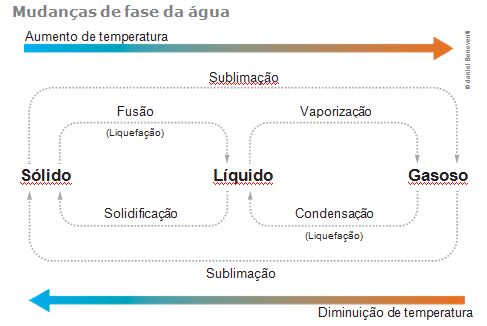
As mudanças de estado físico de qualquer substância recebem os nomes indicados no diagrama a seguir.
Ocorre o aumento da temperatura e absorção de calor. Processo chamado de Endotérmico.
Ocorre diminuição da temperatura e liberação de calor. Processo denominado Exotérmico.
As mudanças de estados físicos, depende da temperatura e da pressão.
As transformações de estado físico da matéria apresentam denominações características, como se pode ver abaixo:
a) FUSÃO: representa a passagem do estado sólido para o estado líquido. A temperatura na qual ocorre recebe o nome de Ponto de Fusão. Por exemplo, o derretimento de um cubo de gelo.

b) VAPORIZAÇÃO: representa a passagem do estado líquido para o estado gasoso. A temperatura na qual ocorre recebe o nome de Ponto de Ebulição. Uma vaporização pode ocorrer de três modos distintos:
– EVAPORAÇÃO:passagem do estado líquido para o estado gasoso que envolve apenas a superfície do líquido. Por exemplo, a secagem de roupas em um varal.
– EBULIÇÃO:passagem do estado líquido para o estado gasoso por meio de aquecimento direto, envolvendo todo o líquido. Por exemplo, o aquecimento da água em uma panela ao fogão.

– CALEFAÇÃO: passagem do estado líquido para o gasoso de modo muito rápido, quase instantâneo. Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.

c) LIQUEFAÇÃO ou CONDENSAÇÃO: representa a passagem do estado gasoso para o estado líquido. Por exemplo, a umidade externa de um frasco metálico ao ser exposto a uma temperatura relativamente elevada.
d) SOLIDIFICAÇÃO: representa a passagem do estado líquido para o estado sólido. Por exemplo, o congelamento da água em uma forma de gelo levada ao refrigerador.

e) SUBLIMAÇÃO: representa a passagem do estado sólido para o estado gasoso ou o processo inverso, sem passagem pelo estado líquido. Por exemplo, a sublimação do gás carbônico sólido, conhecido por gelo seco, em exposição à temperatura ambiente.

Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino Médio. São Paulo: SE, 2014
Fonte:http://blogdequimicaeja.blogspot.com/2017/
CONHEÇA OS OUTROS 5 ESTADOS DA MATÉRIA
Desde o ensino fundamental fomos apresentados aos estados da matéria: sólido, líquido e gasoso. Essa era a resposta que todo mundo acertava. Aprendemos isso mais especificamente com a água, que é facilmente encontrada e visível nesses três estados. É fácil de explicar e de mostrar aos alunos.
No entanto, esses são apenas os três estados básicos da matéria e é agora que vem a surpresa: há no mínimo outros 5 estados possíveis. Essas que conhecemos são parte do nosso dia a dia e são as com que temos “contato” frequentemente, porém há outras formas.
Quando a matéria é exposta à situações extremas ou quando é manipulada em laboratório, muitas são as mudanças que podem ser causadas em suas moléculas.
Confira agora outros 5 estados possíveis da matéria.
1 – Plasma

O plasma é o estado mais abundante em nosso universo, apesar de você não estar familiarizado com ele. A forma do plasma é alcançado quando a água se decompõe, sua forma molecular H2O deixa de existir. O plasma é um gás ionizado quente, presente nas estrelas, nos buracos negros e na atmosfera terrestre.
2 – Sólido amorfo

O vidro é um exemplo dessa matéria. Nesse formato, as moléculas não estão tão organizadas quanto no estado líquido.
3 – Cristal líquido

Você pode não ver, mas provavelmente está interagindo com essa matéria agora mesmo. O cristal líquido está presente nos monitores de computadores e também nas telas de celular. Sua matéria está entre a solidez do cristal e o fluxo líquido. São partículas bem alinhadas que fluem com facilidade.
4 – Condensado de Bose-Einstein
Este é um estado da matéria quando exposta à situações extremas. O condensado de Bose-Eistein ocorre quando os átomos são resfriados perto do zero absoluto, quando isso acontece os átomos individuais formam um único objeto. Alguns acreditam que essas formações são na verdade estrelas invisíveis, que confundimos com buracos negros.
5 – Plasma de quarks e glúons

Esse estado é definido como um fluído quase perfeito. Nesse estado da matéria, ela é milhares de vezes mais quente que o próprio sol.
Aula 4
TEMPERATURA DE FUSÃO E EBULIÇÃO
A temperatura em que uma substância sofre fusão e aquela em que há vaporização por ebulição são características de cada substância, portanto, importantes para identificá-las.
Substância pura
É qualquer material que apresenta as propriedades físicas definidas, determinadas e praticamente invariáveis nas mesmas condições de temperatura e pressão.
Misturas
São constituídos por mais de uma substância (componentes) e cujas propriedades físicas variam para cada amostra nas mesmas condições de temperatura e pressão. Exemplo: sangue.
Para o estudo das temperaturas de ebulição e fusão, acompanhe a construção de um gráfico de temperatura versus tempo de aquecimento de uma amostra de água no estado sólido até chegar ao estado gasoso.



Mudanças de Estado Físico

O que caracteriza e define um estado físico da matéria são as forças atuantes em seu interior; coesão, a qual tende a aproximar as partículas, e repulsão, a qual tende a afastá-las. Quando a força de coesão supera a de repulsão, a substância se apresentará na fase de agregação chamada de sólido, quando as forças apresentarem a mesma intensidade, teremos um líquido, quando a de repulsão superar a de coesão, teremos então um gás.
 Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.
Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.

Na fase de agregação sólida, as partículas não apresentam liberdade de movimento, cabendo-lhes apenas movimentos de ordem vibracional, e a matéria terá maior densidade molecular. No estado líquido, as partículas podem literalmente “rolar” umas sobre as outras. Já na fase gasosa, as partículas terão ampla liberdade de movimento, e a matéria estará em sua fase de menor densidade molecular possível.
A matéria pode apresentar-se em qualquer estado físico, dependendo dos fatores pressão e temperatura. Assim, de modo geral, o aumento de temperatura e a redução de pressão favorecem o estado gasoso, e pode-se dizer que o inverso favorece ao estado sólido.
Aula 5
TEMA 2 – TRANSFORMAÇÃO FÍSICA E QUÍMICA ·
A matéria que nos rodeia está em constante mudança, sofrendo inúmeras transformações. Um copo que parte, uma floresta que arde, o gelo das calotas polares que funde, tudo isto são exemplos de transformações que ocorrem todos os dias. Estas transformações podem ser Físicas ou Químicas.
Transformações Físicas
Mudanças de estado físico da matéria. As transformações físicas da matéria ocorrem quando há por exemplo mudança de estado físico de um determinado material ou uma dissolução de um soluto num solvente. Neste tipo de transformação, não há formação de novas substâncias. É exemplo de uma Transformação Física…
… Objecto que parte ….Um papel amassado … Mudança de estado físico


É possível mudar o estado físico de uma substância provocando afastamento e aproximação de suas moléculas, o que é conseguido por meio de alterações na temperatura ou na pressão.
Essa redução da temperatura diminui a agitação das moléculas.
Pressão atmosférica: Toda a massa de ar existente que exerce uma força sobre tudo o que está na superfície da Terra. Ao nível do mar, a pressão atmosférica atinge o seu valor máximo, que corresponde a 1 atm.
O que acontece no processo de ebulição da água?
As moléculas recebem energia em forma de calor e assim agitam-se mais e “escapam” para a atmosfera.
Se a pressão que atua no líquido diminui, as moléculas se desprendem com mais facilidade, ou seja, com menor grau de agitação, reduzindo a temperatura de ebulição.
SÓLIDO
No estado sólido, as partículas encontram-se muito próximas e unidas por intensas forças de ligação. Elas vibram em posições fixas. Forma e volume constantes e definidos. Permite pouca compressibilidade.
LÍQUIDO
As partículas estão mais afastadas uma das outras, reduzindo as forças de ligação que as mantém unidas. Estão mais livres e se movem com facilidade. Forma variável (recipiente), Volume constante
GASOSO
As partículas encontram-se muito afastadas umas das outras e são praticamente livres. Se movimentam rapidamente em todas as direções e sentidos. A forma e volume são variáveis (de acordo com o recipiente).
Transformações Químicas
Até agora, você viu alguns exemplos de transformações físicas, como as que ocorrem durante uma mudança de estado físico ou a separação dos componentes de uma mistura. O que ocorre de especial em uma transformação química?
Antes de começar o estudo deste tema, reflita a respeito do que você já sabe sobre transformações químicas. Para isso, pense nas seguintes questões:
Quando um objeto metálico enferruja, ele passa a ter certas características diferentes do Reflita sobre algumas dessas características: elas evidenciam que ocorreu uma transformação química?
Como você reconhece que um alimento está podre ou impróprio para o consumo? Quais características dele se altera
As Transformações Químicas ocorrem sempre que há formação de novos materiais, ou seja, a partir dos materiais iniciais formam-se outros materiais diferentes. Ocorre uma transformação química quando…
… se forma um sólido de cor diferente;
… há mudança de cor da solução;
… se forma um gás;
… há variação de temperatura do sistema;
… as substâncias iniciais desaparecem;
… se origina um cheiro característico.
São Exemplos de Transformações Químicas…
… a Respiração Celular que ocorre nos seres vivos;

.. a Fotossíntese realizada pelas plantas;

… cozinhar os alimentos;

… o fogo de artifício.


Evidências da ocorrência de uma transformação química
Você já deve ter tomado algum remédio na forma de pastilha efervescente. Quando a pastilha é adicionada à água, pode-se observar a liberação de um gás. Esse gás não estava lá antes do contato entre a pastilha e a água, o que indica que ele é uma substância nova que se formou no sistema.

Agora, acompanhe uma observação experimental. Em um laboratório, um químico adicionou uma solução aquosa incolor de nitrato de chumbo a uma solução também incolor de iodeto de potássio (veja a figura na página seguinte). Imediatamente, surgiu a geração de gás é uma evidência de transformação química, pois aconteceu a formação de um novo material.um sólido amarelo – uma nova substância que não existia antes da mistura. Se tanto a solução aquosa de nitrato de chumbo quanto a de iodeto de potássio são incolores, o surgimento de um sólido de cor amarela indica a formação de uma nova substância.

COMPETÊNCIA E HABILIDADES: Reconhecer a ocorrência de transformações químicas no dia a dia e no sistema produtivo, Empregar Corretamente A Linguagem Significativa Na Descrição De Uma Transformação Químicas.·
ESTRATÉGIA DE ENSINO: Levantamento das ideias dos alunos; leitura e discussão do texto e das questões para interpretação do teto.·
RECURSOS: Giz, lousa, texto, questões presentes no caderno do aluno.·
AVALIAÇÃO: Resposta das questões e participação das discussões do texto.
Aula 6
TEMA 3
FATORES QUE PODEM SE ANALISADOS NAS TRANSFORMAÇÕES QUÍMICAS.
O tempo gasto.
Há na natureza transformações que podem ser rápidas ou lentas e que esse aspecto pode ser controlado ou modificado.
Os processos de calcinação usados durante o período colonial em alguns países, duravam cerca de três dias para completar a transformação do calcário em gás carbônico e cal viva.
Com a modernização dos fornos, o tempo de produção diminuiu para apenas algumas horas.
Importância de se reduzir o tempo de cozimento dos alimentos e de se aumentar o tempo envolvido na deterioração dos mantimentos.
O fator energia
A absorção e a liberação de energia.
Algumas transformações químicas vão liberar energia, comumente na forma de energia térmica (queima da madeira), ao passo que outras vão absorvê-la (o cozimento de um ovo).
Fenômeno endotérmico absorve energia na forma de calor.
Fenômeno exotérmico libera energia na forma de calor.
A possibilidade de se reverter esses processos.
O fator custo:
É um dos temas de maior importância dentro de uma análise de viabilidade econômica, servindo como indicativo para a escolha das melhores alternativas de produção visando sempre a maximização dos retornos.
O fator mercado:
É aquele em que há um grande número de compradores de um fator de produção, como trabalho ou matéria-prima.
Fator meio ambiente:
Se for prejudicar o meio ambiente, não deve ser produzido.
O cidadão comum espera que o poder público faça legislações que sejam cada vez mais restritivas e severas para disciplinar as condutas ambientais e que fiscalizem de forma eficaz o cumprimento destas leis.
No entanto a Constituição coloca o meio ambiente como um direito fundamental essencial para a dignidade da pessoa humana e impõem ao Poder Público e a coletividade o dever de proteger e preservar.
Art. 225 – Todos têm direito ao meio ambiente ecologicamente equilibrado, bem de uso comum do povo e essencial à sadia qualidade de vida, impondo-se ao Poder Público e à coletividade o dever de defendê-lo e preservá-lo para as presentes e futuras gerações.
Transformação revertível
É quando os reagentes são facilmente recuperáveis sem a adição de novos materiais.
Exemplo: derretimento da parafina na produção de vela e a desidratação do sulfato de cobre pentaidratado.
Transformação irrevertível
É quando não se consegue recuperar os reagentes, a não ser pela adição de outros materiais e por meio de outros procedimentos.
Exemplo: corrosão de um portão de ferro, a dissolução de um comprimido efervescente de sal de fruta, queima do carvão.
Nas transformações reversíveis a formação do produto e a regeneração do reagente ocorrem ao mesmo tempo e seguem os mesmos caminhos.
Exemplo: gelo, amassar um papel, transformar tecido em roupa.
Nas transformações revertíveis o caminho de reação da regeneração dos reagentes não precisa ser o mesmo da formação do produto nem a reação precisa se processar nos dois sentidos ao mesmo tempo.
Transformações instantâneas:
Queima de diversos materiais, explosão de fogos de artifício, efervescência de água oxigenada em contato com uma ferida.
Transformações não instantâneas:
Corrosão de estátuas de mármore, apodrecimento de alimentos, cozimento de alimentos.
Bibliografia
Fonte: Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino Médio, 1ª Série. São Paulo: SE, 2014.
Conteúdos e temas: transformações químicas; energia em processos endo/exotérmicos; tempo envolvido nas transformações; revertibilidade de algumas transformações.·
Competências e habilidades: reconhecer a importância dos fatores tempo, energia e revertibilidade nas interações e transformações químicas que ocorrem no dia a dia e no sistema produtivo.·
Estratégias de ensino: levantamento das ideias dos alunos; aula expositiva dialógica; experimento; problemas, questões abertas e questões de classificação.·
Recursos: materiais e reagentes para realização do experimento. Sugestão de avaliação: respostas às questões e aos problemas e participação na discussão do experimento.
Aula 7
COMO RECONHECER QUE HOUVE UMA TRANSFORMAÇÃO QUÍMICA QUANDO NÃO HÁ EVIDÊNCIAS.
Interações e transformações químicas
Nem toda transformação química é acompanhada de evidências e nem toda evidência indica a ocorrência de uma transformação química.
O ser humano transforma os materiais da natureza para suprir suas necessidades.
As interações entre materiais e entre materiais e energia podem gerar transformações químicas.
Os materiais de partida (reagentes) dão origem aos novos materiais (produtos) nas transformações químicas.
……….Materiais obtidos diretamente da natureza:
Ouro
Madeira
Mármore
Oxigênio
Areia
Água
………Materiais obtidos por transformações de matérias-primas:
Cal
Plástico
Ferro
Alumínio
Cimento
Álcool
Transformações físicas
Ocorrem quando há por exemplo mudança de estado físico de um determinado material ou uma dissolução de um soluto num solvente.
Neste tipo de transformação, não há formação de novas substâncias.
Gelo virando água
Derretimento de um sorvete
Vidro quebrado
Rebuçado é partido em bocados
Transformações químicas
Ocorrem sempre que há formação de novos materiais, ou seja, a partir dos materiais iniciais formam-se outros materiais diferentes.
Evidências de transformações químicas
Sons de efervescência
Mudança de temperatura
Cheiros característicos
Mudança de cor e textura
Transformações químicas
Fotossíntese
Explosão de uma bombinha em pólvora
Corrosão de um cano de cobre
Digestão dos alimentos
Apodrecimento de um pedaço de madeira
Corrosão de uma pia de mármore pelo vinagre
Queima de uma vela
Sublimação do iodo
Bolor nos alimentos
Bibliografia
Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino Médio, 1ª Série. São Paulo: SE, 2014.
http://mundoeducacao.bol.uol.com.br/quimica/substancias-misturas.htm
http://www.aulas-fisica-quimica.com/7q_14.html
Conteúdos e temas: propriedades das substâncias – temperaturas de ebulição e fusão, densidade, solubilidade; importância das propriedades para caracterizar substâncias.·
Competências e habilidades: empregar a linguagem química para representar transformações químicas; construir e interpretar tabelas e gráficos com dados de propriedades das substâncias.·
Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto; atividade experimental; uso de objetos de aprendizagem (simulação).·
Recursos: material para experimentos e textos. Sugestão de avaliação: atividades e questões propostas.
Aula 8
-6 A NECESSIDADE DE SEPARAR MISTURAS E SUA IMPORTÂNCIA PARA O SISTEMA PRODUTIVO.
Substâncias e Misturas
A água destilada é formada só por H2O, sendo uma substância pura. Porém, outros “tipos de água” são misturas porque possuem substâncias dissolvidas
No cotidiano nos referimos a muitos compostos utilizando a palavra “substância”. No entanto, será que estamos fazendo o uso correto dessa palavra? Em química, o que significa “substância”?
Por exemplo, a água destilada é uma substância, pois ela é constituída unicamente de água, ou seja, H2O, e suas propriedades físicas, tais como o ponto de fusão, o ponto de ebulição e a densidade, são bem definidas, conforme mostrado nos dados abaixo, ao nível do mar (1 atm):
PF = 0 ºC
PE = 100 ºC
d = 1,0 g/cm3 a 3,98ºC
A água é um exemplo de substância composta, ou seja, é formada por moléculas com mais de um tipo de elemento. Mas também existem substâncias simples, como o gás oxigênio (O2), que é formado por apenas um tipo de elemento.
Não existem duas substâncias que tenham todas as propriedades exatamente iguais. Veja mais alguns exemplos de substâncias: álcool etílico anidro (sem água), gás carbônico, cloreto de sódio, mercúrio, iodo, ouro, silício, gás nitrogênio, gás hélio e ferro.
Mas não seria correto nos referirmos à água da chuva, do mar, à água mineral, da torneira, à água potável ou de um rio como sendo substâncias. Na realidade essas águas possuem outras substâncias dissolvidas nelas. Por exemplo, a água do mar contém vários sais, como o sal de cozinha (cloreto de sódio – NaCl), que pode ser extraído dela por evaporação e cristalização.
O correto seria dizermos que elas são misturas.
A fusão e a ebulição das misturas ocorrem em determinada faixa de temperatura e apresentam densidades diferentes em função de sua composição.
Por exemplo, o álcool hidratado tem a sua densidade variando de acordo com a porcentagem de álcool etílico e de água que constitui a mistura.
O álcool hidratado é uma mistura homogênea, pois apresenta uma única fase. Outros exemplos de misturas homogêneas são o soro caseiro, o soro fisiológico, a gasolina, o vinagre etc.
No entanto, quando a mistura apresenta mais de uma fase, como, por exemplo, uma mistura de areia e água, dizemos que é uma mistura heterogênea. Também são misturas heterogêneas: quartzo, água e óleo, a própria areia, a madeira, o sangue, o leite, água com gás, entre outros.
Talvez você esteja se perguntando: mas, o leite e o sangue são homogêneos?! Na realidade, eles parecem ter uma única fase a olho nu; porém, os cientistas basearam esse conceito em dois aparelhos sofisticados: o ultramicroscópio e a ultracentrífuga.
Se usarmos um ultramicroscópio para visualizar o álcool hidratado e o sangue, observaremos que o álcool hidratado é totalmente uniforme, enquanto que o sangue apresenta aspecto desigual, sendo, portanto, constituído de mais de uma fase. Além disso, se usarmos uma ultracentrífuga, veremos que haverá uma separação no caso do sangue, como mostra a imagem a seguir:
Na natureza, a grande maioria são misturas e não substâncias.
TIPOS DE MISTURA
Em nosso dia-a-dia é dificílimo encontrarmos substâncias puras na natureza. Em sua grande maioria, as substâncias aparecem em misturas.
Chama-se mistura a união física de duas ou mais substâncias, e a maior parte delas pode ser separada por métodos físicos.
Há dois tipos de mistura.
As misturas podem ser classificadas em homogêneas e heterogêneas de acordo com seu aspecto visual.
Mistura homogênea ou solução: é aquela cujos componentes (soluto e solvente) não se distinguem visualmente, ou seja, ela apresenta uma única fase, que tem as mesmas propriedades por toda a sua extensão. Por exemplo: ar atmosférico filtrado, ligas metálicas e água potável.
Mistura heterogênea: é aquela cujos componentes (soluto e solvente) apresenta mais de uma fase, podem se distinguir visualmente. Por exemplo: granito, concreto, mistura de farinha e água, água e óleo, água e areia.
Soluto
Todo componente minoritário em uma solução.
Solvente
Componente que está em maior quantidade em uma solução.
Fase
Porção de um sistema que apresenta as mesmas propriedades em toda a sua extensão.
Liga
Mistura homogênea de duas ou mais substâncias, sendo pelo menos uma delas um metal.
SEPARAÇÃO DE MISTURAS
A separação das misturas é baseada nas propriedades de cada substância.
Até agora, você estudou três propriedades físicas importantes: a densidade, a temperatura de fusão e a de ebulição. Como elas poderiam ser utiliza- das para separar a mistura de areia, casca- lho, cortiça e sal seus componentes tiverem propriedades diferentes.
Todo processo de separação tem uma lógica associada a característica
daquela substância a ser retirada.
Os processos de separação de misturas mais cobrados em provas
Dentre os vários processos de separação de misturas apresentados, alguns são mais comumente cobrados. Mas atenção, isso não quer dizer que vai cair em sua prova, e sim, que há mais chances de cair que outros, pois tem mais aplicações práticas.
São eles:
Decantação
Destilação Simples
Destilação Fracionada
Cristalização
Floculação
Centrifugação
Decantação – Processo de Separação de Misturas

Eu gosto de comparar a palavra “Decantar” com “Descansar” porque nos faz entender facilmente a ideia desse processo de separação de misturas.
A ideia é que ao deixar a mistura descansando, paradinha, as substâncias mais densas (pesadas) tenderão a se depositar no fundo do recipiente, enquanto as substâncias menos densas (leves), tenderão flutuar, subir. Essa é a ideia da decantação. Após essa separação das substâncias por conta de sua densidade, fica mais fácil de separamos cada uma.
É o caso da separação de água e óleo, separação de misturas de plásticos, limpeza de água turva.
Se você pega uma mistura de água e óleo e deixar ela paradinha, descansando, o óleo vai flutuar na água, enquanto a água vai ser depositada em baixo. O mesmo acontece com a água turva. Pegue uma água barrenta e deixe-a descansar para ver o que acontece. Com o tempo os sólidos dispersos vão decantar, descer para o fundo do recipiente.
O processo de decantação consiste, portanto, em deixar em repouso (“descansar”) a mistura, para que as substâncias mais densas se separem das demais e se depositem no fundo do recipiente.
Veja esse vídeo do Manual do Mundo, em que se faz um teste de adulteração de gasolina. Perceba que após misturar, água, gasolina e álcool, houve uma separação entre os líquidos imiscíveis graças a diferença de densidade entre eles. A gasolina além de não se misturar a àgua, possui menor densidade, concentrando-se na parte superior do recipiente.
Destilação – Processo de Separação de Misturas
A destilação é o processo de separação de misturas que utiliza a volatilidade das substâncias para fazer a separação através do fornecimento de calor. Neste processo, o calor faz um líquido evaporar. Em sequência, o vapor passa por um processo de condensação onde é transformado em líquido novamente, só que dessa vez, com maior grau de pureza.

O processo de Destilação é muito comum para separar líquido de soluto não volátil. Exemplo solução de água e sal. Se você tem uma solução de água e sal, e aquece essa solução, a água vai evaporar enquanto o sal vai continuar no recipiente. Com o tempo terá separado a água do sal. Após o processo será obtida a água destilada e o sal dentro do recipiente. Entendeu?
Um exemplo prático do processo de destilação é o que acontece no processo de fabricação de álcool (etanol). Na indústria sucroalcooleira, após a etapa de fermentação, a mistura formada por água, álcool e outros compostos passa pelo processo de destilação, no qual se consegue separar o álcool (mais volátil) da mistura, e condensá-lo, obtendo o álcool etanol que conhecemos.
Para você conhecer um pouco mais sobre essa aplicação, assista ao vídeo abaixo:

Destilação Fracionada – Processo de Separação de Misturas
A destilação fracionada também utiliza calor para evaporar substâncias e separá-las das demais. A diferença da destilação simples é que neste caso, tem-se uma mistura de substâncias líquidas com pontos de ebulição diferentes. A separação é feita de forma fracionada, tal que, as substâncias de menor ponto de ebulição são separadas primeiro, em seguida, separa-se a substância de maior ponto de ebulição e assim sucessivamente.
Na prática, o processo de destilação fracionada é feita na separação dos constituintes do petróleo.
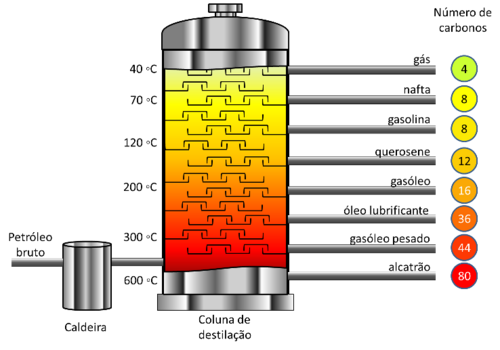
OBS: Tanto o processo de destilação, quanto o de cristalização há fornecimento de calor à solução para evaporar o líquido. A diferença é que na destilação, o vapor passou por um processo de condensação para se transformar em líquido novamente, enquanto no processo de cristalização não, todo o líquido foi evaporado para atmosfera.
Cristalização – Processo de Separação de Misturas
A cristalização é o processo de separação de misturas na qual é fornecido calor para uma solução com intuito de evaporar o solvente e concentrar o soluto até ele cristalizar-se.
Este é o processo utilizado para obtenção do nosso sal de cozinha, que você adiciona nos alimentos.
Veja esse vídeo abaixo para você ver a aplicação prática do processo de cristalização.
Floculação – Processo de Separação de Misturas
Floculação é o processo de separação de misturas em que se formam flocos com o intuito de aumentar a densidade e fazê-lo depositar no fundo do recipiente.

Como isso é feito? A floculação geralmente segue o processo de coagulação em que uma substância química, chamada de coagulante, é adicionada à mistura para que formem coágulos das partículas suspensas. Na etapa de floculação há uma aglutinação desses coágulos se transformando em flocos com maior densidade, que após decantação, sofrem uma deposição, sendo possível sua separação.
A floculação é etapa importante no processo de tratamento da água. Dá uma olhadinha neste vídeo sobre tratamento da água.
Centrifugação – Processo de separação de misturas
A centrifugação separa substâncias com densidades diferentes. Ao contrário da decantação que deixa o líquido em repouso, descansando, a centrifugação faz girar a mistura em uma centrífuga e acelera o processo de separação dos elementos mais densos, que tendem a se deslocar na direção de fuga. Com isso é possível separar as partículas mais densas.
A centrifugação é usada nos diversos ramos da indústria e neste vídeo abaixo te mostro uma aplicação prática deste assunto, o chamado Hidrociclones.
Não sei se você entende espanhol, mas apesar disso, o vídeo abaixo é muito interessante e fácil de entender. Dá uma olhadinha nele para você entender como a centrifugação é um processo de separação de misturas.
Processo de Separação de Misturas modernos
Um moderno processo de separação de misturas muito discutido como alternativa de solução para o problema da seca e fornecimento de água potável em vários países é o processo de Dessalinização de água do mar através da Osmose Reversa. Assista ao vídeo abaixo para conhecer mais sobre este processo.
Conteúdos e temas: separação de misturas.
Competências e habilidades: compreender os processos de separação das misturas ferro/escória no alto-forno e água/álcool aplicando as propriedades específicas estudadas na Situação de Aprendizagem 5.
Sugestão de estratégias de ensino: leituras de textos orientadas por perguntas; pesquisa orientada e apresentações.
Avaliação: respostas às perguntas e apresentação oral e escrita da pesquisa.
Substâncias e Misturas
A água destilada é formada só por H2O, sendo uma substância pura. Porém, outros “tipos de água” são misturas porque possuem substâncias dissolvidas.
No cotidiano nos referimos a muitos compostos utilizando a palavra “substância”. No entanto, será que estamos fazendo o uso correto dessa palavra? Em química, o que significa “substância”?
Por exemplo, a água destilada é uma substância, pois ela é constituída unicamente de água, ou seja, H2O, e suas propriedades físicas, tais como o ponto de fusão, o ponto de ebulição e a densidade, são bem definidas, conforme mostrado nos dados abaixo, ao nível do mar (1 atm):
PF = 0 ºC
PE = 100 ºC
d = 1,0 g/cm3 a 3,98ºC
A água é um exemplo de substância composta, ou seja, é formada por moléculas com mais de um tipo de elemento. Mas também existem substâncias simples, como o gás oxigênio (O2), que é formado por apenas um tipo de elemento.
Não existem duas substâncias que tenham todas as propriedades exatamente iguais. Veja mais alguns exemplos de substâncias: álcool etílico anidro (sem água), gás carbônico, cloreto de sódio, mercúrio, iodo, ouro, silício, gás nitrogênio, gás hélio e ferro.
Mas não seria correto nos referirmos à água da chuva, do mar, à água mineral, da torneira, à água potável ou de um rio como sendo substâncias. Na realidade essas águas possuem outras substâncias dissolvidas nelas. Por exemplo, a água do mar contém vários sais, como o sal de cozinha (cloreto de sódio – NaCl), que pode ser extraído dela por evaporação e cristalização.
O correto seria dizermos que elas são misturas.
A fusão e a ebulição das misturas ocorrem em determinada faixa de temperatura e apresentam densidades diferentes em função de sua composição.
Por exemplo, o álcool hidratado tem a sua densidade variando de acordo com a porcentagem de álcool etílico e de água que constitui a mistura.
O álcool hidratado é uma mistura homogênea, pois apresenta uma única fase. Outros exemplos de misturas homogêneas são o soro caseiro, o soro fisiológico, a gasolina, o vinagre etc.
No entanto, quando a mistura apresenta mais de uma fase, como, por exemplo, uma mistura de areia e água, dizemos que é uma mistura heterogênea. Também são misturas heterogêneas: quartzo, água e óleo, a própria areia, a madeira, o sangue, o leite, água com gás, entre outros.
Talvez você esteja se perguntando: mas, o leite e o sangue são homogêneos?! Na realidade, eles parecem ter uma única fase a olho nu; porém, os cientistas basearam esse conceito em dois aparelhos sofisticados: o ultramicroscópio e a ultracentrífuga.
Se usarmos um ultramicroscópio para visualizar o álcool hidratado e o sangue, observaremos que o álcool hidratado é totalmente uniforme, enquanto que o sangue apresenta aspecto desigual, sendo, portanto, constituído de mais de uma fase. Além disso, se usarmos uma ultracentrífuga, veremos que haverá uma separação no caso do sangue, como mostra a imagem a seguir:
Na natureza, a grande maioria são misturas e não substâncias. Veja alguns exemplos de misturas:
TIPOS DE MISTURA
Em nosso dia-a-dia é dificílimo encontrarmos substâncias puras na natureza. Em sua grande maioria, as substâncias aparecem em misturas.
Chama-se mistura a união física de duas ou mais substâncias, e a maior parte delas pode ser separada por métodos físicos.
Há dois tipos de mistura.
As misturas podem ser classificadas em homogêneas e heterogêneas de acordo com seu aspecto visual.
Mistura homogênea ou solução: é aquela cujos componentes (soluto e solvente) não se distinguem visualmente, ou seja, ela apresenta uma única fase, que tem as mesmas propriedades por toda a sua extensão. Por exemplo: ar atmosférico filtrado, ligas metálicas e água potável.
Mistura heterogênea: é aquela cujos componentes (ou fases) podem se distinguir visualmente. Por exemplo: granito, concreto, mistura de farinha e água, água e óleo, água e areia.
Soluto
Todo componente minoritário em uma solução.
Solvente
Componente que está em maior quantidade em uma solução.
Fase
Porção de um sistema que apresenta as mesmas propriedades em toda a sua extensão.
Liga
Mistura homogênea de duas ou mais substâncias, sendo pelo menos uma delas um metal.
Questões avaliativas separação de misturas
Questão 1
(Fuvest-SP) Para a separação das misturas: gasolina-água e nitrogênio-oxigênio, os processos mais adequados são respectivamente:
a) decantação e liquefação.
b) sedimentação e destilação.
c) filtração e sublimação.
d) destilação e condensação.
e) flotação e decantação.
Questão 2
(Cefet-PR) Para um químico, ao desenvolver uma análise, é importante verificar se o sistema com o qual está trabalhando é uma substância pura ou uma mistura. Dependendo do tipo de mistura, podemos separar seus componentes por diferentes processos. Assinale a alternativa que apresenta o método correto de separação de uma mistura.
a) Uma mistura homogênea pode ser separada através de decantação.
b) A mistura álcool e água pode ser separada por filtração simples.
c) A mistura heterogênea entre gases pode ser separada por decantação.
d) Podemos afirmar que, ao separarmos as fases sólidas e líquida de uma mistura heterogênea, elas serão formadas por substâncias puras.
e) O método mais empregado para a separação de misturas homogêneas sólido-líquido é a destilação.
Questão 3
Faça a associação correta entre as colunas, relacionando a(s) técnica(s) que deve(m) ser empregada(s) para separar os componentes de cada mistura a fim de obter todos os componentes:
Coluna I:
(1) Óleo + água
(2) Álcool + éter
(3) Sal + água
(4) Limalhas de ferro + areia
(5) Areia + cascalho
(6) Ar atmosférico
(7) Sal de cozinha + iodeto de chumbo (insolúvel em água) + água
(8) Óleo + água + sal
(9) Tinta preta
Coluna II:
a) Evaporação
b) Filtração
c) Destilação simples
d) Decantação
e) Destilação fracionada
f) Levigação
g) Decantação e destilação
h) Liquefação
i) Separação magnética
j) Análise cromatográfica ou cromatografia
k) Peneiração ou tamisação
l) Adsorção
Questão 4
Uma das etapas do funcionamento do aspirador de pó, utilizado na limpeza doméstica, é a:
a) filtração.
b) decantação.
c) sedimentação.
d) centrifugação.
e) sifonação.
Aula 9
PRODUÇÃO DO ÁLCOOL COMBUSTÍVEL E DO FERRO·
PRODUÇÃO DO ÁLCOOL
o álcool e a gasolina? qual deles é menos poluente!
O etanol pode ser obtido através da cana-de-açúcar, milho, beterraba, mandioca, batata, etc.
A matéria-prima é submetida a uma fermentação alcoólica, com atuação do micro-organismo Saccharomyces cerevisiae.
Porém, a cana é a mais utilizada, pois apresenta maior produtividade.
Etapas da produção do álcool combustível
A cana-de-açúcar é moída.
O bagaço é utilizado para ser queimado como combustível ou usado na alimentação do gado.
A garapa (suco) é aquecida e se transforma em melaço.
Na presença de leveduras, o melaço passará pelo processo de fermentação alcoólica, que dura cerca de 50 horas.
Impactos ambientais da produção de açúcar e álcool
A cana-de-açúcar foi a primeira cultura introduzida no Brasil, há aproximadamente quatrocentos anos, visando a produção do açúcar, que na época tinha alto valor de mercado. No entanto, com a problemática da poluição pelos combustíveis fósseis e com a implantação do programa Pró-Alcool, em 1975, seu uso para a produção de etanol ganhou imensa força no Brasil. Como os passos iniciais para a produção de álcool e açúcar são basicamente os mesmos, os problemas ambientais em sua cadeia apenas se agravaram.
Por volta de 2010, o Brasil era responsável por cerca de 40% da produção de álcool mundial, da qual 80% era consumida no mercado interno. Em relação ao açúcar, o país é o maior produtor e exportador global, com cerca de 20% da produção e 40% das vendas no mercado internacional.

Monocultura extensiva da cana de açúcar: um grande problema ambiental.
Segundo a pesquisadora Maiara de Melo, “… desde o início da cultura canavieira se observam problemas como o desmatamento e o desgaste do solo. É um modelo econômico que nega e explora a natureza”. De fato, ambos os problemas apresentados mostram-se verdadeiros: o desmatamento ocorre na busca por mais e maiores áreas para o plantio da cana-de-açúcar, altamente lucrativo devido à alta demanda tanto de açúcar quanto de álcool; o desgaste do solo acontece associado ao uso de herbicidas, à utilização de queimadas, com o intuito de facilitar a colheita, e ao cultivo da cana em monoculturas, onde o solo torna-se infértil pelo esgotamento de seus nutrientes.
De forma geral, o sistema sucroalcooleiro (sucro- (francês sucre, açúcar)) possui três etapas: a agrícola, que consiste no processamento da matéria-prima, envolvendo fases de preparo do solo, plantio, tratos culturais, colheita e transporte até a usina; a industrial, a qual compreende a recepção da cana na usina, a lavagem, o tratamento do caldo e a produção de açúcar e álcool; e a de geração de energia, em que a energia produzida pelo processamento do bagaço é reaproveitada como suprimento energético da própria indústria.

Queimadas: um problema não só ambiental, mas de saúde pública.
Nessas fases pode-se observar alto gasto de água (cerca de 1,4L para produzir 1L de álcool, segundo Ballester) e emissão de poluentes atmosféricos pela utilização de queimadas, caldeiras tecnologicamente atrasadas, torres de destilação e dornas de fermentação. Além disso, há formação de fuligem pelas queimadas, consumo de grandes quantidades de insumos químicos agressivos ao meio ambiente (e.g. óleo diesel, soda cáustica, óleos lubrificantes e graxas não biodegradáveis), mau gerenciamento dos resíduos industriais, falta de reservas florestais próximas às regiões de cultivo e uso de vinhaça como fertilizante, a qual é rica em nitrogênio, podendo causar a eutrofização de rios e lagos, quando em excesso.

O processo de produção do açúcar e do álcool desde a recepção da cana na usina.
Visando a redução do impacto, existe uma lei (Nº 11.241/2002) que proíbe as queimadas, porém essa mudança deve acontecer gradativamente até 2017. Junto a isso, existem políticas de zoneamento agroecológico, indicando possíveis áreas para expansão, e de ordenamento do uso do solo, buscando seu uso sustentável. Outras medidas como o uso de tecnologias menos poluentes, a introdução, em larga escala, de controle biológico e a aplicação de adubos e fertilizantes orgânicos, podem ser tomadas no intuito de proteger o meio ambiente.
A cana-de-açúcar não é apenas mais um produto agrícola, mas uma importante fonte de biomassa energética. O grande desafio do Brasil agora é reduzir os impactos ambientais da atividade sucroalcooleira e, ao mesmo tempo, aumentar a produtividade, contribuindo para o crescimento econômico e proporcionando oferta de trabalho e geração de renda no país.
A história da cana-de-açúcar confunde-se com a do próprio Brasil. Fundamental para a colonização do nosso território pelos portugueses, ela ainda hoje desempenha um importante papel em nossa economia.
Apesar de tanta riqueza, é impossível divorciar a produção nacional de cana-de-açúcar da intensa exploração de trabalhadores. No tempo em que éramos colônia, escravos negros moviam as propriedades de senhores de engenho. Na década de 1970, foi a vez dos chamados “boias-frias” enfrentarem condições precárias com o Próalcool
Autores: Marino da Motta Nanzer, Rafael Farina, Silvia Sayuri Mandai e Vanessa Thomé.
Bibliografia utilizada:
- Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino Médio, 1ª Série. São Paulo: SE, 2014.
- http://brasilescola.uol.com.br/geografia/etanol.htm
- http://trabalhonacana.escravonempensar.org.br/apresentacao
- <https://www.ufpe.br/agencia/index.php?option=com_content&view=article&id= 39727:producao-do-etanol-gera-impactos-ambientais-ainda-sem-monitoramento&catid=441& Itemid=77>.
- Impacto Ambiental da Cana-de-Açúcar. Embrapa – Monitoramento por satélite. Disponível em:<http://www.cana.cnpm.embrapa.br/setor.html>.
- Pesquisa analisa impacto ambiental da cana-de-açúcar. Novacana.com. Disponível em: <http://www.novacana.com/n/cana/meio-ambiente/pesquisa-analisa-impactos-das-mudancas-no-uso-da-terra/>/
Produção do ferro
QUÍMICA
A produção do ferro gusa (ferro de primeira fundição ainda não purificado) é um processo químico que utiliza a redução de minérios de ferro para gerar o principal formador do aço.

O ferro gusa é uma liga composta de ferro (cerca de 0,1%), carbono (de 3% a 6%), manganês (cerca de 0,5%), silício (de 1% a 4%) e enxofre (cerca de 0,1 %). Sua produção é realizada rotineiramente em altos fornos em formato de cuba, com cerca de 30 metros de altura.
A produção do ferro gusa é uma atividade do setor siderúrgico de extrema importância econômica pelo fato de corresponder à grande parte do custo da produção do aço. A produção dessa liga ocorre por meio do processo de redução do ferro presente em minérios que contêm esse elemento.
Assim, a produção do ferro gusa depende da utilização de minérios de ferro, ou seja, minérios formados por óxidos de ferro, os quais não apresentam nenhuma utilização para a produção do aço, mas que são fundamentais para a extração do ferro.
Diversas são as formas de extrair o ferro dos minérios, as quais foram aperfeiçoadas ao longo da história, uma vez que a utilização de ligas formadas a partir de ferro data de antes de Cristo. Porém, a técnica mais utilizada para a produção de ferro gusa é a redução em altos fornos, a qual será abordada neste texto.
Minérios para a produção do ferro gusa
Os principais minérios de ferro utilizados na produção do ferro gusa são:
- Hematita (Fe2O3);
- Magnetita (Fe3O4);
- Limonita (Fe2O3.nH2O);
- Carbonato de siderita (FeCO3).
Matéria-prima
Para a produção do ferro gusa em alto forno, são necessárias as seguintes matérias-primas para cada tonelada de material produzido:
- Minério de ferro: cerca de 1700 Kg;
- Coque (um tipo de carvão): cerca de 500 Kg;
- Óxido de cálcio (CaO) ou óxido de magnésio (MgO): cerca de 140 Kg;
- Ar quente: cerca de 1800 Kg.
Etapas da produção do ferro gusa
1o Passo: Extração do minério de ferro;
2o Passo: Mistura do minério de ferro com o coque e óxido de cálcio (ou óxido de magnésio);
3o Passo: Injeção de ar preaquecido (em temperatura de aproximadamente 1200 oC). O gás oxigênio do ar reage com o carvão e produz o monóxido de carbono (CO), que é o agente redutor do processo de produção do ferro gusa;
C + O2 → CO(g)
4o Passo: O calor do ar quente e da combustão do carvão realizam a fusão do minério de ferro;
5o Passo: Concomitantemente, ocorre a reação química entre o monóxido de carbono e o óxido de ferro (como a hematita), formando o ferro metálico (Fe) fundido, isto é, o ferro gusa, além de elementos como carbono, enxofre, manganês, etc.
Fe2O3 + 3 CO → 2 Fe + 3CO2

Recolhimento do ferro gusa fundido
Obs.: Existem empresas siderúrgicas produtoras do ferro gusa que, ao produzi-lo, já produzem em seguida o aço a partir dele. Da mesma forma, existem ainda aquelas indústrias que produzem apenas o ferro gusa para servir de fonte de abastecimento para outras que trabalham com a produção e manufatura do aço.
Danos causados ao meio ambiente
A produção do ferro gusa é extremamente importante econômica e industrialmente, porém, sua realização, principalmente em altos fornos, leva aos seguintes danos ambientais:
- Intenso desmatamento para a produção de carvão;
- Aumento da emissão de dióxido de carbono no ar atmosférico;
- Emissão de óxidos de enxofre na atmosfera;
- Emissão de poluentes orgânicos de potencial cancerígeno.
Entretanto, na contramão dos danos ambientes causados, várias empresas que realizam a produção do ferro gusa efetuam o plantio de árvores que serão utilizadas na produção do carvão. Essas árvores utilizam na fotossíntese parte do dióxido de carbono formado na produção do ferro gusa.
Por Me. Diogo Lopes Dias
Gostaria de fazer a referência deste texto em um trabalho escolar ou acadêmico? Veja:
DIAS, Diogo Lopes. “Produção do ferro gusa”; Brasil Escola. Disponível em
Semana
-9 IMPLICAÇÕES SOCIOAMBIENTAIS DA PRODUÇÃO E O USO DE COMBUSTÍVEIS.·
Conteúdos e temas: problemas sociais e ambientais ligados à produção e ao uso de combustíveis; conceito operacional de ácido e base.·
Competências e habilidades: selecionar, organizar, relacionar e interpretar dados e informações apresentados em textos, tabelas e gráficos referentes aos problemas socioambientais provenientes da produção e do uso de combustíveis (chuva ácida e efeito estufa) para tomar decisões e enfrentar situações-problema; relacionar informações obtidas por meio de observações diretas e de textos descritivos para construir argumentações consistentes num debate sobre desenvolvimento tecnológico e impactos socioambientais.·
Sugestão de estratégias de ensino: levantamento das ideias dos alunos; leitura de textos; experimentos; debate; exposição dialogada.·
Sugestão de recursos: lousa e giz; roteiros experimentais; textos e questões presentes neste Caderno; materiais e reagentes indicados nos roteiros dos experimentos.
Sugestão de avaliação: respostas às questões e participação na aula; material escrito sobre o tema do debate
Impactos Ambientais
Os minérios são indispensáveis para a manutenção da atividade industrial, tendo em vista que produtos como automóveis, máquinas, tratores, cimento, entre outros, são fabricados a partir de matérias-primas vindas dessa extração.
A exploração mineral se tornou mais evidente a partir da Primeira Revolução Industrial (final do século XVIII, início do século XIX), quando a produção em massa intensificou a extração de minérios para abastecer a crescente indústria. Com o crescimento populacional mundial houve a necessidade de retirar da natureza um volume cada vez maior desse tipo de recurso.
No Brasil, os principais problemas oriundos da mineração podem ser englobados em quatro categorias: poluição da água, poluição do ar, poluição sonora, e subsidência do terreno. Em geral, a mineração provoca um conjunto de efeitos não desejados que podem ser denominados de externalidades. Algumas dessas externalidades são: alterações ambientais, conflitos de uso do solo, depreciação de imóveis circunvizinhos, geração de áreas degradadas e transtornos ao tráfego urbano. Estas externalidades geram conflitos com a comunidade, que normalmente têm origem quando da implantação do empreendimento, pois o empreendedor não se informa sobre as expectativas, anseios e preocupações da comunidade que vive nas proximidades da empresa de mineração.

Efeitos sócio-ambietais da mineração

Inicialmente, a mineração afeta a cobertura vegetal, em graus variados, desde a supressão total ou parcial na área a ser minerada, até a utilização de grandes volumes de água, em geral oriundas do próprio lençol freático, através de poços perfurados para trabalhos de estudos preliminares. A atividade de extração gera profundas alterações, modificando toda estrutura física e social do local onde está situada a mina e a região no entorno.
O método de lavra é o mais utilizado na exploração das substâncias minerais e é um dos principais fatores determinantes do nível de impacto ao ambiente, tendo grande influência na modificação da paisagem e escasseamento de recursos naturais. A grande maioria dos bens minerais é lavrada por métodos tradicionais a céu aberto onde o comprometimento ambiental é muito grande.
Nesse método de extração, para se ter um maior aproveitamento do minério, acaba-se gerando uma maior quantidade de estéril, poeira em suspensão, vibrações e maiores riscos de poluição das águas subterrâneas e superficiais. Minas a céu aberto elevam gradativamente a produção de rejeitos, os subprodutos da mineração ou lixo, resultantes da escavação e extração que não interessam a empresa mineradora e, portanto precisam ser descartados.
Considerando que o objetivo da empresa é livrar-se dos rejeitos da forma menos onerosa possível, para tanto se necessita da criação de uma área de descarte adjacente à área de lavra, sacrificando ainda mais a vegetação existente no entorno da mina. A depender da posição geográfica das barragens, construídas para serem depositados os rejeitos, não são descartadas as possibilidades de vazamentos ou rompimentos, comprometendo significativamente todo o ambiente através da contaminação dos reservatórios de águas superficiais e subterrâneas.
A má utilização da água por parte das grandes mineradoras tem gerado conflitos em função da inversão dos usos prioritários e por políticas públicas que suprimem a população local. As políticas públicas sempre vêm em benefício das grandes empresas, excluindo principalmente a população pobre. Comumente as indústrias mineradoras sugam grande parte da água através da perfuração de poços ou canalização de rios, limitando o uso para fins industriais negando sempre o uso humano e animal
No Brasil, a extração de pedras preciosas ou semipreciosas é desenvolvida por uma atividade denominada de garimpo, nela são obtidos ouro, diamante, esmeralda, cassiterita e etc. A garimpagem geralmente é executada de forma tradicional nas margens de rios, em locais que recebem grande volume de sedimentação e em planícies fluviais, principalmente nas Bacias hidrográficas do Amazonas e do Paraguai.
O garimpo mecanizado produz profundos impactos nos ambientes fluviais, destruindo as margens dos rios e modificando profundamente a paisagem. Sem contar que contamina as águas com aplicação de mercúrio e outros detritos; o prejuízo ambiental é muito elevado, pois os rios são assoreados, a fauna é contaminada, a cobertura vegetal é retirada e compromete a saúde do homem.
Os danos gerados nas áreas onde são desenvolvidas a mineração ou garimpagem são irreversíveis. Diante desses fatos percebemos que a lucratividade oriunda da extração mineral fica nas mãos de uma minoria e os prejuízos ambientais para toda a população atual e também futura.
Fonte. Geografia humana do Brasil
http://https://www.youtube.com/watch?v=8sovsUzYZFM
Aula 10
Semana
Tempo previsto: 4 aulas- 7 COMBUSTÍVEIS: COMBUSTÃO NO DIA A DIA E NO SISTEMA PRODUTIVO.·
Conteúdos e temas: uso de diferentes combustíveis; caloria; poder calorífico; reação de combustão.· Competências e habilidades: analisar dados referentes às massas e à energia envolvida na queima de combustíveis, estabelecendo relações de proporcionalidade entre essas duas grandezas.·
Sugestão de estratégias de ensino: levantamento das ideias dos alunos; exposição dialogada.·
Sugestão de recursos: lousa e giz; questões presentes neste Caderno.
Sugestão de avaliação: respostas às questões e participação nas aulas.
Aula 10
Semana
– 8 RELAÇÕES EM MASSA NAS TRANSFORMAÇÕES QUÍMICAS CONSERVAÇÃO E PROPORÇÃO EM MASSA.·
Conteúdos e temas: conservação de massa nas transformações químicas e relações proporcionais entre as massas envolvidas em uma transformação química.·
Competências e habilidades: perceber a conservação da massa nas transformações químicas; analisar dados de massas de reagentes e de produtos estabelecendo relações de proporcionalidade entre eles; aplicar os conceitos de conservação e proporção em massa na previsão de quantidades envolvidas nas transformações químicas.·
Sugestão de estratégias de ensino: exposição dialogada; experimento demonstrativo; exercícios. Sugestão de recursos: lousa e giz; questões presentes neste Caderno; materiais e reagentes indicados nos roteiros dos experimentos. Sugestão de avaliação: respostas às questões e participação na discussão do experimento
Aula 11
Símbolos e Fórmulas
Símbolos
São conhecidos atualmente mais de 100 elementos químicos. Cada um deles tem um nome e um símbolo diferente.
Os símbolos são a representação dos elementos químicos. São formados por uma, duas ou três letras. A primeira é sempre maiúscula e a segunda, é sempre minúscula. O símbolo de um elemento vem de uma ou duas letras tiradas de seu nome em latim.
Por causa disso, nem todos os símbolos têm relação lógica com o nome do elemento em português.
Os que têm três letras não têm nomes oficiais, atribuídos pela Iupac (União Internacional de Química Pura e Aplicada).
Fórmulas
Todas as substâncias são formadas por átomos.
As substâncias simples são formadas por átomos de um único elemento e as substâncias compostas são formadas por átomos de dois ou mais elementos diferentes.
Moléculas
As moléculas são as menores unidades que apresentam a composição característica de uma substância. As moléculas são formadas pela união de dois ou mais átomos.
Para representar graficamente as moléculas de uma substância, seja ela simples ou composta, os químicos utilizam fórmulas. A fórmula da água é H2O. Outras fórmulas usadas pelos químicos são CO2 (gás carbônico), N2 (gás nitrogênio), O2 (gás oxigênio), O3 (gás ozônio), C2H6O (etanol), C6H12O6 (glicose), NH3 (amônia) e H2SO4 (ácido sulfúrico).
Na fórmula de uma substância são colocados os símbolos dos elementos que tornam parte de sua composição e os índices de atomicidade (ou, simplesmente, atomicidade), que indicam a proporção em que os átomos do elemento estão presentes na substância. Se o índice de
Aula 7
Semana
Equação química
Os reagentes são como ingredientes em uma receita de bolo e é claro que o produto será o bolo quando estiver pronto.
A equação química é a forma de se descrever uma reação química. Os reagentes são mostrados no lado esquerdo da equação e os produtos no lado direito.

Exemplo: a reação de síntese da amônia.
Ao analisar a reação nota-se que uma molécula nitrogênio (N2) reage com 3 moléculas de hidrogênio (H2) para formar 2 moléculas de amônia (NH3).
Lei de Lavoisier ( Lei da conservação das massas)
Num sistema fechado, quando duas ou mais substâncias reagem entre si, a massa total dos produtos é igual a soma das massas das substâncias reagentes.
“Na natureza nada se cria, nada se perde; tudo se transforma”
Massa dos reagentes = Massa dos produtos
Exemplos:
1) Considerando um sistema fechado a reação química:

Temos 5g de A e 10g de B, a massa total dos reagente é 15g.
De acordo com a lei de Lavoisier a massa total dos produtos será 15g.
2) Se em uma reação:

Massa de A = 10g
Massa de B = 30g
Massa de D = 12g
Qual é a massa de C?
De acordo com a lei de Lavoisier:
“massa dos reagentes = massa dos produtos”
Massa dos reagentes = A + B = 10g + 30g =40g
Massa dos produtos = C + D = C + 12g
40g = C + 12g
C = 28g
Lei de Proust
As massas dos reagentes e as massas dos produtos que participam de uma reação obedecem sempre a uma proporção constante. Essa proporção é característica de cada reação, isto é, independe da quantidade de reagentes utilizados.
Exemplo:
1) Para a reação entre o hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:
| Hidrogênio(g) | Oxigênio(g) | Água(g) |
| 10 | 80 | 90 |
| 2 | 16 | 18 |
| 1 | 8 | 9 |
| 0,4 | 3,2 | 3,6 |
Observa-se que a massa do produto é igual à soma da massa dos reagentes, o que concorda com a Lei de Lavoisier.
As massas dos reagentes e dos produtos que participam de uma reação química podem ser diferentes, mas as relações entre elas são sempre constantes, Consequências da Lei de Proust, como pode ser conferido na tabela abaixo:
mO/mH = massa do oxigênio dividido pela massa do hidrogênio.
mágua/mH = massa da água dividido pela massa do hidrogênio.
mágua/mO = massa da água dividido pela massa do oxigênio.
Lei de G-Lussac
“Os volumes de todas as substâncias gasosas envolvidas em um processo químico estão entre si em uma relação de números inteiros e simples, desde que medidos à mesma temperatura e pressão”.
1 L de H2 + 1 L de Cl2 = 2 L de HCl
Relação de números inteiros e simples: 1:1:2
Cabe aqui observar que nem sempre a soma dos volumes dos reagentes é igual à dos produtos. Isso quer dizer que não existe lei de conservação de volume, como ocorre com a massa.
10 L de H2 + 5 L de O2 = 10 L de H2O
Relação de números inteiros e simples: 10:5:10,que pode ser simplificada por 2:1:2
Nas CNTP, o volume molar é igual a 22,4 L/mol.
Exemplo:
1) A reação de síntese da amônia, considerando a temperatura e a pressão constante.

Nota-se que para a reação ocorrer é necessário 1L de N2 e 3L de H2 para formar 2L de NH3 ( amônia).
Aula 8
Balanceamento por tentativa
No balanceamento, os coeficientes devem estar corretamente indicados, posicionados sempre à esquerda da fórmula da substância, seja ela do produto, seja do reagente. Respeitando a Lei de Lavoisier que enuncia sobre as reações químicas realizadas em sistema fechado, onde as massas dos produtos é igual as massas dos reagentes. Se a equação não estiver balanceada, não estará respeitando o fato de os átomos se conservarem.
De forma prática, realizar o balanceamento de uma equação química é igualar a quantidade dos átomos dos elementos presentes nos reagentes com a quantidade desses mesmos átomos dos elementos presentes nos produtos.
O recurso que utilizamos para realizar o balanceamento de uma equação química é a utilização de números inteiros, denominados de coeficientes, posicionados sempre à esquerda da fórmula da substância, seja ela do produto, seja do reagente. Convencionalmente, sempre utilizamos os menores números inteiros possíveis. Veja a representação a seguir:
Exemplo, para se formar uma molécula de água:

Os números em vermelhos,são os coeficientes, e indicam que para se forma uma molécula de água é necessário se ter 1 molécula de Hidrogênio (1 H2) e meia molécula de Oxigênio (1/2 O2 )
Quando escrevemos uma equação química, ela deve estar corretamente balanceada, ou seja, os coeficientes devem estar corretamente indicados. Caso contrário, não estará observando o fato de os átomos se conservarem e com a proporção errada a reação não ocorerá.
Uma forma de se balancear uma reação química é pelo método de tentativas, que constitui dar valores arbitrários aos coeficientes estequiométrico de modo a tentar igualar os números de átomos dos reagentes e dos produtos.
Exemplo:
A combustão do etanol (C2H6O), álcool combustível, produz gás carbônico e água. A reação está representada a seguir:
![]()
Vamos analisar o número de átomos nos reagente e nos produtos:

Nota-se que os números dos átomos carbonos dos reagentes (CR) e dos carbonos dos produtos (CP) são diferentes, e o mesmo se nota nos hidrogênios dos produtos (HP) e dos reagentes (HR).
Para que a reação ocorra é necessário fazer o balanceamento ( obs: sempre deixe o Oxigênio para ser balanceado no final ).
– Vamos fazer por etapas;
1°) Balancear o Carbono
– Observe que nos reagentes temos 2 Carbonos e nos produtos temos 1 Carbono, como podemos igualar:
2 C = x 1C
– Qual valor multiplicado por 1 dará 2? (sempre o coeficiente menor é multiplicado)
x = 2
O valor de “X” será o coeficiente do carbono do produto

Agora vamos balancear o hidrogênio
2°) Balancear o Hidrogênio
– Observe que temos 6 Hidrogênios no reagentes e 2 Hidrogênios nos produtos
– Qual valor multiplicado por 2 dará 6 ? (sempre o coeficiente menor é multiplicado)
6H = y2H
y = 3
O valor de “y” será o coeficiente do hidrogênio do produto.

ATENÇÃO: Note que a quantidade de oxigênio foi alterada devido ao balanceamento dos produtos, agora temos:

Se colocarmos um coeficiente no C2H6O vai ser alterado toda a reação então o coeficiente é colocado no O2
3°) – Então qual valor multiplicado por 2 dará 6 ? ( lembrando que já se tem um Oxigênio no C2H6O)
2z = 6
Z = 3 coeficiente do O2

Agora vamos ver se o balanceamento esta correto:

Os números dos átomos dos produtos e dos reagentes estão iguais, com isso a reação está balanceada.
Balanceamento resumido

Dicas para balanceamento de equações;
Como o balanceamento de equações é feito sempre por tentativa, não existem regras específicas que nos ajudem. Todavia, algumas orientações podem ser úteis.
1º Sempre iniciar o balanceamento pela maior fórmula. Entende-se como maior fórmula aquela que apresenta a maior quantidade de átomos.
2º Escolher os elementos que aparecem uma única vez nos reagentes e uma única vez nos produtos
3º Escolher o elemento que as quantidades NÃO são iguais nos reagentes e produtos
4º Se no 2º passo ainda houver elementos bons para que se possa trabalhar o balanceamento, o ideal é dar prioridade para os elementos cujas quantidades NÃO SÃO NÚMEROS MÚLTIPLOS DOS REAGENTES e PRODUTOS
5º Dar sequência ao balanceamento por elementos que já estão definidos, ou seja balanceados, seja no reagente ou no produto
Vamos utilizar um bom exemplo com o Carbono e o Ácido nítrico que reagem para formar gás carbônico, óxido nítrico e água. Mesmo sendo uma reação de óxido-redução, é possível determinar seus coeficientes.
C + HNO 3 à CO 2 + NO 2 + H 2 O
Bem, seguindo as nossas dicas , iremos analisar o primeiro passo:
C + HNO 3 à CO 2 + NO 2 + H 2 O
Podemos descartar o Oxigênio de imediato, já que ele se repete várias vezes no produto.
Todos os outros C, H e N aparecem 1 única vez tanto nos reagentes como nos produtos porém temos que começar por apenas um deles.
Segundo passo:
Observando a quantidade de átomos de C no reagente, percebemos que é a mesma no produto, portanto não nos serve para começar e da mesma maneira o N com 1 átomo no reagente e 1 átomo no produto. Então percebemos o H que tem 1 átomo no reagente e 2 átomos no produto. Finalmente encontramos por quem iremos começar.
Se dois átomos de hidrogênio saem , dois átomos deverão entrar e portanto :
C + 2 HNO 3 à CO 2 + NO 2 + H 2 O
O terceiro e quarto passo serão definidos a seguir :
Quando adicionamos o número 2 como coeficiente, deve-se lembrar que acabou de ser alterada a quantidade de Nitrogênio (N) e de Oxigênio (O). Então agora temos entrando como reagente 2 átomos de N e 2 átomos de O, que estabelecendo as proporções e Leis de Lavoisier, deverão sair também recombinados nos produtos. Então, já podemos adicionar o coeficiente 2 à molécula de óxido nítrico (NO 2 )
C + 2 HNO 3 à CO 2 + 2 NO 2 + H 2 O
Agora pense um pouco. Como temos 6 átomos de Oxigênio entrando deverão sair em quantidade igual. Porém em nossos produtos temos 3 moléculas que tem o átomo de O, e quando completamos o óxido nítrico com o coeficiente 2, temos aí 4 átomos de Oxigênio só nessa molécula que somados a molécula de d’água, totalizam 5 átomos de Oxigênio. Pergunta-se o que será feito com o átomo que se encontra na molécula de gás carbônico que nos demonstra 2 átomos e que se somados aos outros átomos de oxigênio dos produtos, totalizam 7 átomos ?
C + 2 HNO 3 à CO 2 + 2 NO 2 + H 2 O
Fácil, adicionamos o coeficiente 1/2 na molécula que tem o CO 2 onde temos o Carbono, para balanceá-lo. Se multiplicarmos 1/2 . 2 = 1.
C + 2 HNO 3 à 1/2 CO 2 + 2 NO 2 + H 2 O
Resolvido o problema do Oxigênio, vamos pensar no átomo de Carbono que ficou com 1/2 átomo no produto. Resolveremos introduzindo o mesmo coeficiente no reagente, balanceando por final o Carbono.
1/2 C + 2 HNO 3 à 1/2 CO 2 + 2 NO 2 + H 2 O
Se você necessitar que a resolução seja em números inteiros, transforme-os. Se o denominador é o número 2, multiplique tudo por 2 e pronto.
Em uma reação química os números colocados antes da fórmula de cada substância, seja reagente ou produto, são chamados de coeficientes estequiométricos ou simplesmente, coeficientes. Estes informam a proporção entre as quantidades em mols dos participantes de uma dada reação química.
Exercícios Balanceamento
1) As equações a seguir são de reações de deslocamento entre ametais, e não estão balanceadas, então forneça os coeficiente que tornem as equações
balanceadas.
a) Cl2 + HI → HCl + I2
b) F2 CaCl → CaF2 + Cl2
c) Br2 + H2S → HBr + S8
2) Forneça os coeficientes que torne a equações balanceadas.
a) Na2O + HCl → NaCl + H2O
b) SO2 + NaOH → Na2SO3 + H2O
c) N2O4 + H2O → HNO2 + HNO3
3) complete as equações químicas com os coeficiente que faltam para balancear a equação.
a) 1 CaH2 + __ H2O → __ Ca(OH)2 + 2 H2
b) __ CH2O + 1 O2 → __ CO2 + 1 H2O
c) __ C4H8O2 + __ O2 → 4 CO2 + __ H2O
d) ___ (NH4)3PO4 + 3 BaBr2 → 1 Ba3(PO4)2 + ___ NH4Br
Aula 21
Estequiometria
Se em uma reação química é conhecido a quantidade de reagente (ou reagentes) pode-se calcular a quantidade de produtos formados.

Se em uma reação química a quantidade de produto formado (ou produtos) é conhecida pode se calcular a quantidade de regentes consumidos.

Em geral, as reações químicas combinam proporções definidas de compostos químicos. Já que a matéria não pode ser criada ou destruída, a quantia de cada elemento deve ser a mesma antes, durante e após a reação, ou seja, a quantidade de produtos tem que ser iguais às quantidades de reagentes. E a estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Regra geral para a estequiometria
1° Escrever a equação química do processo.
2° Fazer o balanceamento da equação química.
3° Montar as proporções baseando-se nos dados e nas perguntas do problema.
4°Utilizar regras de três para chegar à resposta.
Exemplos
1) A reação de formação da água é:

– Qual a quantidade em grama de oxigênio e de hidrogênio necessário para se ter 72g de H2O?
1° Montar a reação química

2° Balancear a equação

3° montar as proporções

4° fazer regra de 3

Para se ter 72g de água será preciso reagir 8g de hidrogênio com 64g de Oxigênio.
Fonte: https://quimik.webnode.com.br
Aula 9
Semana
SITUAÇÃO DE APRENDIZAGEM 5 QUANTIDADE DE MATÉRIA E SUA UNIDADE (MOL)
Mol
É usado para relacionar a quantidades de matérias, de substâncias. Seu uso é comum para simplificar representações de proporções químicas e no cálculo de concentração de substâncias.
Podemos fazer uma analogia com a “dúzia” que também é utilizada para descrever quantidades.
Exemplo:
Se eu falar que tenho uma dúzia de balas, eu terei 12 balas. Com o mol é a mesma idéia só que o valor não será 12(doze), mas uma quantidade de 6,022×1023 do que estiver sendo relacionado.
| Simplificando |
| 1 dúzia = 12 quantidades |
| 1mol = 6,022×1023quantidades |
Então Se em vez de eu dizer que tenho uma dúzia de balas eu falar que tenho 1(um) mol de bala, quer dizer que eu tenho 6,022×1023 balas,Para se calcular a quantidade de mol de uma molécula usa-se a seguinte formula:
Exemplos:
1) Tenho 60g de água (H2O), qual a quantidade de mols?
Primeiramente tem que se calcular a massa molecular da água:
H = 1u
O = 16u
Então a massa molecular vai ser: 2x(1u) + (16u) = 18u
Colocando esse valor na formula, teremos:
Massa molar
Está relacionada com a constante de Avogadro, e o seu valor numérico é o mesmo que a massa molecular, mas a unidade passa a ser gramas por mol (g/mol).
Exemplo:
1) A massa molecular da glicose (C6H12O6) é de 179,04u, qual é a sua massa molar?
Como a massa molar e a molecular tem o mesmo valor, o que vai mudar é a unidade, ou seja, a massa molar será de 179,04g/mol
Significa que para se ter 1 mol de glicose é preciso 179,04g.
Constante de Avogadro
Pela definição, pode-se concluir que 1 mol de qualquer elemento terá sempre o mesmo número de partículas. Esse número é denominado constante de Avogadro (NA) que, com aproximação de 4 dígitos, é igual a 6,022 1023 partículas por mol.
Exercícios
1) Em 72g de água qual a quantidade de mol?
2) Se tem 400g de NaOH qual é a quantidade de mol?
3) Sabe-se que a massa atômica de um elemento Z é igual a 240 u e sua se tem 38,4 g deste elemento, então qual será a quantidade de mol?
a) ( ) 0,166
b) ( ) 0,10
c) ( ) 16
d) ( ) 0,16
e) ( ) 166
4) uma dúzia corresponde a 12 unidades e 1 Mol corresponde á:
a) ( ) 1000000 unidades
b) ( ) 6,023 x1023 unidades
c) ( ) 6,023×1063 unidades
d) ( ) 8,023×1023 unidades
Aula 21
Semana
SITUAÇÃO DE APRENDIZAGEM 6 PREVISÃO DAS QUANTIDADES DE REAGENTES E DE PRODUTOS NAS TRANSFORMAÇÕES QUÍMICAS
Nesta Situação de Aprendizagem, você terá condições de prever, nas transformações químicas,
as quantidades de reagentes a ser utilizadas e as de produtos a ser obtidas. Nas indústrias, esse cálculo
é essencial para não haver desperdício de matéria-prima e para prever quanto será produzido
na transformação.
Atividade 1 – Prevendo quantidades envolvidas nas transformações químicas:
relação entre massa e quantidade de matéria
Exercícios em sala de aula
1. Observe a representação da combustão do gás hidrogênio (H2) e complete a tabela, indicando o
nome das substâncias e a quantidade de matéria, em mol, de cada uma delas.
2 H2(g) + O2(g) → 2 H2O(g)
Nome das substâncias
Quantidade de matéria em mol 2 mol
2. Observe novamente a equação anterior, considerando a proporção entre reagentes e produtos, e
responda:
a) Se pretendermos obter 8 mol de água, qual deverá ser a quantidade de matéria utilizada,
em mol, de gás hidrogênio? E a de gás oxigênio?
b)Ao utilizarmos 6 mol de gás hidrogênio, qual será a quantidade de matéria necessária,
em mol, de gás oxigênio? Que quantidade de matéria, em mol, de água será formada?
Balanceamento de equações químicas
Balanceamento de equações químicas
A maneira de representar uma reação química é denominada equação química.
Os números que indicam a proporção entre as quantidades de moléculas, numa equação química, são chamados de coeficientes ou coeficientes estequiométricos.
Observe a decomposição da água:
2H2O à 2H2 + O2
Nesta equação, o coeficiente da água é 2, o do hidrogênio é 2 e o do oxigênio é 1 e não o vemos porque não há necessidade de ser escrito.
Essa equação pode ser lida da seguinte maneira: Duas moléculas de água reagem para formar duas moléculas de hidrogênio e uma de oxigênio.
Lembre-se que o que vem antes da seta chama-se reagente e depois da seta os produtos:
REAGENTES à PRODUTOS
Os reagentes são como ingredientes em uma receita de bolo e é claro que o produto será o bolo quando estiver pronto.
No balanceamento, os coeficientes devem estar corretamente indicados, posicionados sempre à esquerda da fórmula da substância, seja ela do produto, seja do reagente. Respeitando a Lei de Lavoisier que enuncia sobre as reações químicas realizadas em sistema fechado, onde as massas dos produtos é igual as massas dos reagentes. Se a equação não estiver balanceada, não estará respeitando o fato de os átomos se conservarem.
De forma prática, realizar o balanceamento de uma equação química é igualar a quantidade dos átomos dos elementos presentes nos reagentes com a quantidade desses mesmos átomos dos elementos presentes nos produtos.
O recurso que utilizamos para realizar o balanceamento de uma equação química é a utilização de números inteiros, denominados de coeficientes, posicionados sempre à esquerda da fórmula da substância, seja ela do produto, seja do reagente. Convencionalmente, sempre utilizamos os menores números inteiros possíveis. Veja a representação a seguir:
Como o balanceamento de equações é feito sempre por tentativa, não existem regras específicas que nos ajudem. Todavia, algumas orientações podem ser úteis.
1º Sempre iniciar o balanceamento pela maior fórmula. Entende-se como maior fórmula aquela que apresenta a maior quantidade de átomos.
2º Escolher os elementos que aparecem uma única vez nos reagentes e uma única vez nos produtos
3º Escolher o elemento que as quantidades NÃO são iguais nos reagentes e produtos
4º Se no 2º passo ainda houver elementos bons para que se possa trabalhar o balanceamento, o ideal é dar prioridade para os elementos cujas quantidades NÃO SÃO NÚMEROS MÚLTIPLOS DOS REAGENTES e PRODUTOS
5º Dar sequência ao balanceamento por elementos que já estão definidos, ou seja balanceados, seja no reagente ou no produto
Vamos utilizar um bom exemplo com o Carbono e o Ácido nítrico que reagem para formar gás carbônico, óxido nítrico e água. Mesmo sendo uma reação de óxido-redução, é possível determinar seus coeficientes.
C + HNO 3 à CO 2 + NO 2 + H 2 O
Bem, seguindo as nossas dicas , iremos analisar o primeiro passo:
C + HNO 3 à CO 2 + NO 2 + H 2 O
Podemos descartar o Oxigênio de imediato, já que ele se repete várias vezes no produto.
Todos os outros C, H e N aparecem 1 única vez tanto nos reagentes como nos produtos porém temos que começar por apenas um deles.
Segundo passo:
Observando a quantidade de átomos de C no reagente, percebemos que é a mesma no produto, portanto não nos serve para começar e da mesma maneira o N com 1 átomo no reagente e 1 átomo no produto. Então percebemos o H que tem 1 átomo no reagente e 2 átomos no produto. Finalmente encontramos por quem iremos começar.
Se dois átomos de hidrogênio saem , dois átomos deverão entrar e portanto :
C + 2 HNO 3 à CO 2 + NO 2 + H 2 O
O terceiro e quarto passo serão definidos a seguir :
Quando adicionamos o número 2 como coeficiente, deve-se lembrar que acabou de ser alterada a quantidade de Nitrogênio (N) e de Oxigênio (O). Então agora temos entrando como reagente 2 átomos de N e 2 átomos de O, que estabelecendo as proporções e Leis de Lavoisier, deverão sair também recombinados nos produtos. Então, já podemos adicionar o coeficiente 2 à molécula de óxido nítrico (NO 2 )
C + 2 HNO 3 à CO 2 + 2 NO 2 + H 2 O
Agora pense um pouco. Como temos 6 átomos de Oxigênio entrando deverão sair em quantidade igual. Porém em nossos produtos temos 3 moléculas que tem o átomo de O, e quando completamos o óxido nítrico com o coeficiente 2, temos aí 4 átomos de Oxigênio só nessa molécula que somados a molécula de d’água, totalizam 5 átomos de Oxigênio. Pergunta-se o que será feito com o átomo que se encontra na molécula de gás carbônico que nos demonstra 2 átomos e que se somados aos outros átomos de oxigênio dos produtos, totalizam 7 átomos ?
C + 2 HNO 3 à CO 2 + 2 NO 2 + H 2 O
Fácil, adicionamos o coeficiente 1/2 na molécula que tem o CO 2 onde temos o Carbono, para balanceá-lo. Se multiplicarmos 1/2 . 2 = 1.
C + 2 HNO 3 à 1/2 CO 2 + 2 NO 2 + H 2 O
Resolvido o problema do Oxigênio, vamos pensar no átomo de Carbono que ficou com 1/2 átomo no produto. Resolveremos introduzindo o mesmo coeficiente no reagente, balanceando por final o Carbono.
1/2 C + 2 HNO 3 à 1/2 CO 2 + 2 NO 2 + H 2 O
Se você necessitar que a resolução seja em números inteiros, transforme-os. Se o denominador é o número 2, multiplique tudo por 2 e pronto.
- 1/2 C + 2.2HNO 3 à 2.1/2 CO 2 + 2.2 NO 2 + 2.1 H 2 O Teremos o seguinte :
- 1C + 4 HNO 3 à 1 CO 2 + 4 NO 2 + 2 H 2 O , como o coeficiente 1 não tem necessidade de ser escrito: C + 4 HNO 3 à CO 2 + 4 NO 2 + 2 H 2 O
Exemplos de balanceamento
A) C2H6O + O2 → CO2 + H2O
A maior fórmula é o C2H6O (possui nove átomos). Por isso, ela recebe o coeficiente 1.
1 C2H6O + O2 → CO2 + H2O
Assim, concluímos que ela possui dois átomos de carbono (multiplicamos a quantidade 2 da fórmula pelo coeficiente). Agora, para igualar a quantidade de átomos de carbono no reagente e no produto, colocamos o coeficiente 2 na fórmula onde o carbono aparece no produto.
1 C2H6O + 2 O2 → 2 CO2 + H2O
Depois, voltamos à fórmula inicial e observamos que nela o hidrogênio apresenta seis átomos (6 vezes 1). Por isso, nos produtos, na fórmula onde está o hidrogênio, colocamos o coeficiente 3, porque 3 vezes 2 resulta em 6.
1 C2H6O + O2 → 2 CO2 + 3 H2O
Observação: Não foi analisado o oxigênio anteriormente porque ele aparece em mais de uma fórmula no produto e no reagente. Sempre que isso acontecer, ele ficará por último. Isso também pode acontecer com outro elemento.
Para finalizar, falta o coeficiente no O2. Vamos tomar como referência a quantidade do oxigênio no produto porque todas as fórmulas possuem coeficiente. No produto, há sete átomos de oxigênio (2.2 + 3.1), logo, deve haver sete no reagente. É visível que já existe um átomo na fórmula do C2H6O; assim, basta colocar o coeficiente 3 (3 vezes o 2 do O2 resultará em 6 átomos). Somando os seis átomos com 1 do 1 C2H6O, teremos os sete.
1 C2H6O + 3 O2 → 2 CO2 + 3 H2O
B) Na2CO3 + HCl → NaCl + H2O + CO2
A maior fórmula é o Na2CO3 por ter seis átomos. Por isso, ela recebe o coeficiente 1.
1 Na2CO3 + HCl → NaCl + H2O + CO2
Analisando a equação, percebemos que ela apresenta dois átomos de sódio (multiplicamos a quantidade 2 da fórmula pelo coeficiente). Assim, vamos até a fórmula em que o sódio aparece no produto (NaCl) e colocamos o coeficiente 2, haja vista que 2 vezes o número de átomos na fórmula igualará a quantidade de átomos de sódio no reagente e no produto.
1 Na2CO3 + HCl → 2 NaCl + H2O + CO2
Ainda analisando a primeira fórmula, vemos que ela tem um átomo de carbono, que é exatamente a quantidade de carbono na fórmula do produto. Assim, a fórmula do produto recebe o coeficiente 1.
1 Na2CO3 + HCl → 2 NaCl + H2O + 1 CO2
Nessa reação, temos oxigênio no reagente apenas na fórmula em que foi iniciado o balanceamento. Nessa fórmula, há 3 oxigênios (vezes 1 do coeficiente). Por isso, nesse exemplo, podemos trabalhar com o oxigênio antes de terminar o balanceamento. Como no produto temos 2 oxigênios no CO2 e 1 no H2O, o H2O deverá receber obrigatoriamente o coeficiente 1.
1 Na2CO3 + HCl → 2 NaCl + 1 H2O + 1 CO2
Para finalizar, vamos colocar o coeficiente 2 na frente do HCl para igualar as quantidades nos produtos e reagentes.
1 Na2CO3 + 2 HCl → 2 NaCl + 1 H2O + 1 CO2
Fe2(CO3)3 + H2SO4 → Fe2(SO4)3 + H2O + CO2
A maior fórmula é o Fe2(CO3)3 por ter 14 átomos. Por isso, ela recebe o coeficiente 1.
1 Fe2(CO3)3 + H2SO4 → Fe2(SO4)3 + H2O + CO2
Como há dois átomos de ferro (2.1), na fórmula em que há o ferro no produto, colocamos o coeficiente 1, pois nela já existem dois átomos desse elemento.
1 Fe2(CO3)3 + H2SO4 → 1 Fe2(SO4)3 + H2O + CO2
Retornando à fórmula inicial, vemos que ela possui três átomos de carbono (3.1.1, respectivamente 3 dos parênteses, 1 da fórmula e 1 do coeficiente). Assim, na fórmula em que há o carbono no produto, colocamos o coeficiente 3, pois nela há apenas 1 átomo de carbono.
1 Fe2(CO3)3 + H2SO4 → 1 Fe2(SO4)3 + H2O + 3 CO2
O próximo a ser observado é o enxofre (S), pois o oxigênio aparece em várias fórmulas, e a fórmula em que o enxofre está no produto já recebeu o coeficiente 1. Nessa fórmula, observamos que existem três átomos de enxofre (3.1.1, respectivamente 3 dos parênteses, 1 da fórmula e 1 do coeficiente), assim, na fórmula em que esse elemento está no reagente, colocamos o coeficiente 3.
1 Fe2(CO3)3 + 3 H2SO4 → 1 Fe2(SO4)3 + H2O + 3 CO2
Para finalizar, basta colocar o coeficiente 3 no H2O para que a quantidade de hidrogênio se iguale com a do reagente (seis átomos – 3.2).
1 Fe2(CO3)3 + 3 H2SO4 → 1 Fe2(SO4)3 + 3 H2O + 3 CO2
Observação: Se o coeficiente 1 não for o ideal para iniciar o balanceamento, poderá ser utilizado qualquer outro número. Vale ressaltar que números fracionários também podem ser utilizados como coeficientes caso haja necessidade.
D) C + O2 → CO
Para balancear a equação, basta posicionarmos o coeficiente ½ no O2, pois ½ vezes 2 é igual a 1 (que é a quantidade do produto).
C + 1O2 → CO
2
EXERCÍCIOS BALANCEAMENTO DE EQUAÇÕES
A) C2H6O + O2 → CO2 + H2O
B) Na2CO3 + HCl → NaCl + H2O + CO2
C) C6H12O6 → C2H6O + CO2
D) C4H10 + O2 → CO2 + H2O
E) FeCl3 + Na2CO3 → Fe2(CO3)3 + NaCl
F) NH4Cl + Ba(OH)2 → BaCl2 + NH3 + H2O
G) Ca(OH)2 + H3PO4 → Ca3(PO4)2 + H2O
H) Fe2(CO3)3 + H2SO4 → Fe2(SO4)3 + H2O + CO2
I) Na2O + (NH4)2SO4 → Na2SO4 + H2O + NH3
J) FeS2 + O2 → Fe2O3 + SO2
K) NH3 + O2 → NO + H2O
L) KMnO4 + H2SO4 → Mn2O7 + K2SO4 + H2O
M) CS2 + O2 → CO2 + SO2
N) H3PO4 + CaO → Ca3(PO4)2 + H2O
O) Na2CO3 + H3PO4 → Na3PO4 + H2O + CO2
P) KMnO4 → K2MnO4 + MnO2 + O2
Q) Na + KNO3 → Na2O + K2O + N2
R) Ni(CO)4 → Ni + CO
S) CaC2 + H2O → C2H2 + CaO
QUESTÕES DE VESTIBULAR
01 (FUVEST) A decomposição térmica de 1 mol de dicromato de amônio é representada pela equação:
(NH4)2Cr2O7 → N2 + CrxOy + z H2O
Os valores de x, y e z são, respectivamente:
- a) 2, 3 e 4
- b) 2, 7 e 4
- c) 2, 7 e 8
- d) 3, 2 e 4
- e) 3, 2 e 8
02 (ESAL/MG) A equação química:
Mg(OH)2 + x HCl → MgCl2 + H2O
fica estequiometricamente correta se x for igual a:
- a) 1
- b) 2
- c) 3
- d) 4
- e) 5
03 (PUCCAMP) Num “sapato de cromo”, o couro é tratado com um banho de “licor de cromo”, preparado através da reação representada pela equação:
Na2Cr2O7 + x SO2 + H2O → y Cr(OH)SO4 + Na2SO4
Depois de balanceada com os menores coeficientes inteiros possíveis, ela apresenta:
x y
- a) 3 2
- b) 2 3
- c) 2 2
- d) 3 3
- e) 2 1
04 (UNIP/SP) A soma dos menores coeficientes inteiros que balanceiam a equação:
Cl2 + NH3 → N2H4 + NH4Cl é
- a) 4
- b) 15
- c) 21
- d) 8
- e) 6
05 (OSEC/SP) A soma dos coeficientes da equação abaixo é igual a
Br2 + KOH → KBrO3 + KBr + H2O
- a) 13
- b) 20
- c) 19
- d) 15
- e) 18
(UFC/2007) Alguns compostos químicos são tão instáveis que sua reação de decomposição é explosiva. Por exemplo, a nitroglicerina se decompõe segundo a equação química abaixo:
x C3H5(NO3)3 (l) –> y CO2 (g) + z H2O (l) + w N2 (g) + k O2 (g)
A partir da equação, a soma dos coeficientes x + y + z + w + k é igual a:
A) 11
B) 22
C) 33
D) 44
E) 55
Resolução:
Após balanceamento, a equação fica assim representada:
4 C3H5(NO3)3 (l) –> 12 CO2 (g) + 10 H2O (l) + 6 N2 (g) + 1 O2 (g)
Logo, a soma será 33.
Resp.: C
GABARITOS
- A) 1, 3, 2, 3 K) 4, 5, 4, 6
- B) 1, 2, 2, 1, 1 L) 2, 1, 1, 1, 1
- C) 1, 2, 2 M) 1, 3, 1, 2
- D) 2, 13, 8, 10 N) 2, 3, 1, 3
- E) 2, 3, 1, 6 O) 3, 2, 2, 3, 3
- F) 2, 1, 1, 2, 2 P) 2, 1, 1, 1
- G) 3, 2, 1, 6 Q) 10, 2, 5, 1, 1
- H) 1, 3, 1, 3, 3 R) 1, 1, 4
- I) 1, 1, 1, 1, 2 S) 1, 1, 1, 1
- J) 4, 11, 2, 8
01 A 02 D 03 A 04 D 05 E
Aula 21
Semana
Reações Químicas
As Reações Químicas são o resultado de ações entre substâncias que geralmente formam outras substâncias.
Assim, as moléculas presentes nessas substâncias sofrem alterações gerando novas moléculas. Por sua vez, os átomos dos elementos permanecem inalterados.
Classificação das reações
As reações químicas (com presença de substâncias reagentes e resultantes) são classificadas de quatro maneiras, a saber:
- Reações de Síntese ou Adição (A+B → AB): corresponde a reação entre duas substâncias reagentes gerando uma mais complexa, por exemplo: C + O2 → CO2.
- Reações de Análise ou de Decomposição (AB → A+B): corresponde a reação onde uma substância reagente se divide em duas ou mais substâncias simples, por exemplo: 2HGO → 2HG + O2. Essa decomposição pode ocorrer de três maneiras: pirólise (decomposição do calor), fotólise (decomposição da luz) e eletrólise(decomposição da eletricidade).
- Reações de Deslocamento ou de Substituição ou de Simples Troca (AB+C → AC+B ou AB+C → CB+A): corresponde a reação entre uma substância simples e outra composta, levando à transformação da substância composta em simples, por exemplo: Fe + 2HCL → H2 + FeCl2.
- Reações de Dupla-Troca ou de Dupla Substituição (AB+CD → AD+CB): correspondem as reações entre duas substâncias compostas que permutam entre si os elementos químicos, gerando duas novas substâncias compostas, por exemplo: NaCl + AgNO3 → AgCl + NaNO3.
Quando Ocorre uma Reação Química?
Dependendo da condição de temperatura, concentração de substâncias e do contato entre elementos químicos envolvidos, as reações químicas podem ocorrer de maneira rápida ou lenta
As reações gasosas, por exemplo, são rápidas. No entanto, as reações entre elementos líquidos e sólidos são lentas.
Sendo assim, uma reação química ocorre quando duas ou mais substâncias entram em contato, as quais reagem resultando uma nova substância. Para que ela ocorre, os reagentes presentes nas reações químicas devem ter afinidade química para reagirem.
Note que as reações químicas endotérmicas absorvem energia, posto que a energia química dos reagentes é menor que a dos produtos.
As reações químicas exotérmicas, por sua vez, liberam energia, pois a energia química dos reagentes é maior que a dos produtos.
Saiba mais em Reações Endotérmicas e Exotérmicas e Entalpia.
As reações de oxirredução ocorrem entre metais (tendência para ceder elétrons) e não-metais (tendência para receber elétrons). Como exemplo podemos citar a oxidação(ferrugem) que surgem nos metais com o passar do tempo.
Nesse sentido, vale lembrar que a maioria das reações químicas ocorrem entre substâncias de caraterísticas opostas. Por exemplo: substâncias de caráter oxidante e redutor ou as substâncias de caráter ácido e básico.
Por sua vez, as reações que não são de oxirredução podem ocorrer de três maneiras e geralmente são reações de dupla troca:
- Quando um dos produtos for menos solúvel que os reagentes, por exemplo, entre o cloreto de sódio (NaCl) e o nitrato de prata (AgNO3): NaCl + AgNO3 → AgCl + NaNO3
- Quando um dos produtos for mais volátil que os reagentes, por exemplo, entre o cloreto de sódio (NaCl) e o ácido sulfúrico (H2SO4): 2NaCl + H2SO4 → Na2SO4 + 2 HCl
- Quando um dos produtos for menos ionizável que os reagentes, por exemplo, entre o ácido clorídrico (HCl), composto ionizável, e o hidróxido de sódio (NaOH), composto iônico, o qual resulta num composto iônico (sal) e um composto molecular (água): HCl + NaOH → NaCl + H2O
atomicidade nã
Aula 13
Semana 03 de agosto
Replanejamento do 3° Bimestre, revisão do conteúdo ministrado, retirado duvidas sobre as notas, orientação e auto avaliação do professor.
Aula 14
Semana 13/08 a 06/09
SITUAÇÃO DE APRENDIZAGEM 1 A LINGUAGEM QUÍMICA E A CONSTRUÇÃO
HISTÓRICA DA TABELA PERIÓDICA
Conteúdos e temas: linguagem química (símbolos e fórmulas) e tabela periódica.
Competências e habilidades: ler símbolos químicos e compreender o significado dessa simbologia
em termos de partículas (átomos).
Avaliação: participação nas atividades; leitura e avaliação dos textos produzidos, resolução dos exercícios no caderno.
Estrutura Atômica
Os átomos são partículas infinitamente pequenas que constituem toda matéria no universo. Ao longo do tempo, a ideia de como seria a estrutura atômica foi mudando de acordo com as novas descobertas feitas pelos cientistas. Você poderá saber mais sobre isso no texto Evolução do Modelo Atômico. A estrutura atômica é composta por três partículas fundamentais: prótons (com carga positiva), nêutrons (partículas neutras) e elétrons (com carga negativa).
Um modelo é uma representação da realidade (não a própria realidade), assim, os modelos atômicos são representações dos principais componentes do átomo e de sua estrutura e explicam determinados comportamentos físicos e químicos da matéria. Isso é feito porque ainda não é possível ao ser humano enxergar um átomo isolado nem mesmo com ultramicroscópios.
Para se ter uma ideia do quanto o átomo é pequeno, saiba que a menor partícula visível em um microscópio comum contém mais de dez bilhões de átomos! O átomo é tão pequeno que, se colocássemos um milhão deles lado a lado, não atingiríamos a espessura de um fio de cabelo.
Entre os modelos atômicos, o mais usado atualmente no Ensino Médio para o entendimento da estrutura do átomo e suas propriedades é o de Rutherford-Bohr. Segundo esse modelo, a estrutura do átomo é constituída de duas partes principais: o núcleo e a eletrosfera.
A eletricidade chega às nossas casas através de fios e da movimentação de partículas negativas que fazem parte dos elétrons, que circulam pelos fios.
No núcleo de um átomo estão os prótons e os nêutrons e, girando em torno desse núcleo, estão os elétrons.
* Núcleo: Constituindo-se como a parte central do átomo, ele é compacto, maciço e muito denso, além de ser formado pelas partículas de maior massa, que são os prótons e os nêutrons.
Ilustração de prótons e nêutrons que compõem o núcleo atômico
– Prótons: são partículas de carga elétrica positiva (carga relativa = +1; carga em coulomb (C) = +1,602 . 10-19) e a sua massa relativa é igual a 1.
O fato de que os prótons formam o núcleo e dão a ele uma carga total positiva foi descoberto por Eugen Goldstein, em 1886, através de uma modificação na ampola de Crookes e alguns experimentos. Ele viu que, sob voltagens elevadíssimas, apareciam emissões (raios anódicos – restos de átomos do gás que estavam dentro da ampola e que tiveram seus elétrons arrancados pela descarga elétrica). Ao colocar um campo elétrico ou magnético externo à ampola, esses raios eram desviados no sentido do polo negativo. Isso significava que existiam partículas subatômicas positivas, que foram chamadas de prótons.
Mais tarde, Ernest Rutherford (1871-1937) realizou o experimento descrito no texto O átomo de Rutherford, que o levou à descoberta da localização do próton: no núcleo.
– Nêutrons: são partículas de massa igual à dos prótons (1), mas como o próprio nome indica, eles são neutros, ou seja, não possuem carga elétrica.
Os nêutrons foram descobertos, em 1932, por James Chadwick (1891-1974), que percebeu que o núcleo do berílio radioativo emitia partículas neutras com a massa praticamente igual à massa dos prótons (na verdade,
O diâmetro do núcleo depende da quantidade de prótons e nêutrons que o átomo possui, mas, em média, fica em torno de 10-14 m e 10-15 m.
O núcleo atômico concentra praticamente toda a massa do átomo, sendo uma parte muito pequena mesmo: tanto o próton como o nêutron são cerca de 100 mil vezes menores do que o próprio átomo inteiro! A título de comparação, imagine que aumentássemos o núcleo do átomo do elemento hidrogênio (que possui somente um próton) até o tamanho de uma bola de tênis, o elétron mais próximo ficaria a uns três quilômetros de distância! Mesmo se um átomo fosse aumentado até ficar da altura de um prédio de 14 andares, seu núcleo seria do tamanho de um mero grão de sal no sétimo andar. É realmente algo espantoso, não acha?!
* Eletrosfera: É uma região onde os elétrons ficam girando ao redor do núcleo. Apesar de ser uma região de volume muito maior que o do núcleo, ela é praticamente vazia, pois cada elétron é 1836 vezes menor que 1 próton (ou que 1 nêutron). É por isso que a massa do átomo concentra-se praticamente toda no núcleo. Os elétrons são partículas de carga elétrica negativa (-1).
Os elétrons foram descobertos, em 1897, por Joseph John Thomson (1856-1940), o criador do modelo atômico de Thomson. O experimento de Thomson pode ser visto em detalhes no texto O experimento de Thomson com descargas elétricas, mas, de forma resumida, ele usou a ampola de Crookes já mencionada e percebeu que os raios catódicos eram sempre atraídos pelo polo positivo, o que provava que o átomo possuia partículas negativas, que foram chamadas de elétrons.
Os elétrons giram ao redor do núcleo bilhões de vezes por milionésimo de segundo, dando forma ao átomo e fazendo-o comportar-se como se fosse sólido.
Ilustração de eletrosfera com três camadas eletrônicas e elétrons girando ao redor do núcleo
Resumidamente, podemos fazer uma tabela para diferenciar as três partículas subatômicas principais que fazem parte da estrutura do átomo:
Massa e carga elétrica das três partículas subatômicas principais – prótons, nêutrons e elétrons
Os átomos de todos os elementos químicos são compostos por essas três partículas subatômicas. O que difere um elemento químico de outro é a quantidade em que essas partículas aparecem, principalmente a quantidade de prótons no núcleo, que é chamada de número atômico. Continue estudando sobre isso por meio do texto Elemento Químico.
Prótons
O próton é uma partícula fundamental na estrutura atômica. Juntamente com os nêutrons, forma todos os núcleos atômicos, exceto para o hidrogênio, onde o núcleo é formado de um único próton.
A massa de um átomo é a soma das massas dos prótons e nêutrons. Como a massa do elétron é muito pequena (tem cerca de 1/1836,15267377 da massa do próton), ela não é considerada.
A massa do átomo é representada pela letra (A). O que identifica um elemento é o número de prótons (P) do átomo, conhecido como número atômico (Z) do elemento.
É representado pela letra (Z). O número da massa (A) do átomo é formado pela soma do número atômico (Z) com o número de nêutrons (N), ou seja, A = Z + N.
Nêutrons
O nêutron são partículas neutras que fazem parte da estrutura atômica dos átomos, juntamente com os prótons. Ele tem massa, mas não tem carga.
A massa é muito parecida com a do próton. O nêutron se localiza na porção central do átomo (núcleo).
Para se calcular a quantidade de nêutron que um átomo possui basta fazer a subtração entre o número de massa (A) e o número eletrônico (Z).
Elétrons
O elétron é uma partícula subatômica que circunda o núcleo atômico, sendo responsável pela criação de campos magnéticos elétricos.
Um próton na presença de outro próton se repele, o mesmo ocorre com os elétrons, mas entre um próton e um elétron existe uma força de atração. Dessa maneira atribui-se ao próton e ao elétron uma propriedade física denominada carga elétrica.
Os elétrons dos átomos giram em órbitas específicas e de níveis energéticos bem definidos. Sempre que um elétron muda de órbita, um pacote de energia seria emitido ou absorvido.
Essa teoria envolve conhecimentos da mecânica quântica e estes pacotes de energia são chamados quantum.
Cada núcleo de um determinado elemento químico tem o mesmo número de prótons.
Esse número define o elemento químico e número atômico do elemento e determina sua posição na tabela periódica.
Em alguns casos acontece de um mesmo elemento ter átomos com números diferentes. Esses são chamados de isótopos.
Aula 15
Semana 13/08 a 06/09
Isótopos, isóbaros e isótonos
Os isótopos, isóbaros e isótonos são classificações dos átomos dos elementos químicos presenta na tabela periódica, de acordo com a quantidade de prótons, elétrons e nêutrons presentes em cada um deles.
Assim, os isótopos são elementos que apresentam mesmo número de prótons, os isóbaros possuem mesmo número de massa, enquanto que os isótonos possuem mesmo número de nêutrons.
Importante destacar que os prótons (p) possuem carga positiva, os elétrons (e), carga negativa e os nêutrons (n), não apresentam carga (neutralidade) e de acordo com a estrutura dos átomos, os prótons e os nêutrons estão concentrados no núcleo, enquanto que os elétrons estão localizados na eletrosfera, ou seja, em volta do núcleo.
Elemento Químico
Cada elemento químico da tabela periódica é representado pela letra que indica o elemento, por exemplo o H (hidrogênio), donde na parte superior aponta-se o número de massa (A), enquanto que o número atômico localiza-se na parte inferior da letra, por exemplo: zHA
Número Atômico (Z)
O número atômico (Z) representa a quantidade de prótons ou elétrons presentes em cada átomo. Assim, o número de prótons é igual ao número de elétrons (p = e), já que o átomo corresponde a uma partícula eletricamente neutra, ou seja, com o mesmo número de cargas opostas: prótons de carga positiva e elétrons de carga negativa.
Número de Massa (A)
O número de massa (A) de cada átomo, corresponde a soma dos prótons e dos nêutrons (A= p + n) presentes em cada elemento. Importante notar que o elétron, na medida que possui uma massa insignificante, isto é, 1836 vezes menor em relação aos prótons e nêutrons, não estão inclusos na soma das massas dos elementos químicos. Por esse motivo, o número de massa não corresponde a massa efetiva ou real do átomo.
Isótopos
Os isótopos (isotopia) são átomos de um mesmo elemento químico os quais apresentam o mesmo número atômico (Z) e diferentes números de massa (A).
Isóbaros
Os isóbaros (isobaria) são átomos de distintos elementos químicos os quais apresentam o mesmo número de massa (A) e diferentes números atômicos (Z).
Isótonos
Os Isótonos (isotonia) são átomos de elementos químicos distintos os quais apresentam diferentes números atômicos (Z), diferentes números de massa (A) e o mesmo número de nêutrons.
Exercícios
Segundo a representação dos elementos químicos abaixo, o cálcio (Ca), o potássio (K) e o argônio (Ar) podemos classificá-los como isótopos, isótonos ou isóbaros?
20Ca40, 19K40, 18Ar40
Se na representação do elemento químico, o número de massa corresponde a soma dos prótons e dos nêutrons (A= p + n) na representação acima, nota-se que os números que aparecem na parte superior da letra são iguais: 40.
Dessa forma, conclui-se que o cálcio, o potássio e o argônio são elementos isóbaros visto que possuem o mesmo número de massa (A) e diferentes números atômico (Z), estes, representado pelos números localizados na parte inferior do elemento (20, 19, 18).
2. De acordo com a classificação dos elementos químicos (isótopos, isóbaros e isótonos), agrupe os átomos apresentados:
90A232, 91B234, 90C233, 92D233, 93E234.
Note que todos os elementos acima apresentam o número de massa e o número atômico, contudo não apresentam o número de nêutrons. Dessa maneira, para agrupá-los segundo a classificação química (isótopos, isóbaros e isótonos), deve-se calcular o número de nêutrons presentes em cada elemento, pela fórmula (A= p + n):
Elemento A: 90A232
A= p + n
232=90+n
232-90=n
142=n
Elemento B: 91B234
A= p + n
234=91+n
234-91=n
143=n
Elemento C: 90C233
A= p + n
233=90+n
143=n
Elemento D: 92D233
A= p + n
233=92+n
141=n
Elemento E: 93E234
A= p + n
234=93+n
141=n
Logo,
Os elementos A e C são isótopos pois possuem o mesmo número atômico e diferentes números de massa; os elementos (B e E) e (C e D) são isóbaros uma vez que possuem mesmo número de massa e diferentes números atômicos; e, por fim, os elementos (B e C) e (D e E) são isótonos pois apresentam o mesmo número de nêutrons e diferentes números de massa e número atômico.
vídeo aula
EXERCÍCIOS SOBRE A ESTRUTURA DO ÁTOMO
(FUVEST) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 17
2. (FUVEST) A seguinte representação, X = símbolo do elemento químico, refere-se a átomos com:
a) Igual número de nêutrons;
b) Igual número de prótons;
c) Diferentes números de elétrons;
d) Diferentes números de atômicos;
e) Diferentes números de oxidação;
3. (MACK) Indique a alternativa que completa corretamente as lacunas do seguinte período: “Um elemento químico é representado pelo seu ___________, é identificado pelo número de __________ e pode apresentar diferente número de __________ .”
a) nome – prótons – nêutrons.
b) nome – elétrons – nêutrons.
c) símbolo – elétrons – nêutrons.
d) símbolo – prótons – nêutrons.
e) símbolo – – elétrons – nêutrons.
4. (STA. CASA) A questão deve ser respondida de acordo com o seguinte código:
A teoria de Dalton admitia que:
I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;
II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;
III. Átomos de elementos diferentes têm propriedades diferentes.
a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.
5. Um átomo de número atômico Z e número de massa A:
a) tem A nêutrons.
b) tem A elétrons.
c) tem Z prótons.
d) tem A – Z nêutrons.
e) tem Z elétrons.
6. (UFU-MG) O átomo é a menor partícula que identifica um elemento químico. Ele possui duas partes, a saber: uma delas é o núcleo, constituído por prótons e nêutrons, e a outra é a região externa – a eletrosfera-, por onde circulam os elétrons. Alguns experimentos permitiram a descoberta das características das partículas constituintes do átomo.
Em relação a essas características, indique a alternativa correta.
a) prótons e elétrons possuem massas iguais e cargas elétricas de sinais opostos.
b) entre as partículas atômicas, os elétrons têm maior massa e ocupam maior volume no átomo.
c) entre as partículas atômicas, os prótons e os nêutrons têm maior massa e ocupam maior volume no átomo.
d) entre as partículas atômicas, os prótons e os nêutrons têm mais massa, mas ocupam um volume muito pequeno em relação ao volume total do átomo.
7. (PUC-PR) Dados os átomos de 92U238 e 83Bi210, o número total de partículas (prótons, elétrons e nêutrons) existentes na somatória será:
a) 641
b) 528
c) 623
d) 465
e) 496
8. (UFCE) Na tentativa de montar o intrincado quebra-cabeça da evolução humana, pesquisadores têm utilizado relações que envolvem elementos de mesmo número atômico e diferentes números de massa para fazer a datação de fósseis originados em sítios arqueológicos. Quanto a esses elementos, é correto afirmar que são:
a) isóbaros
b) isótonos
c) isótopos
d) alótropos
e) isômeros
9.(UFRJ) Alguns estudantes de Química, avaliando seus conhecimentos relativos a conceitos básicos para o estudo do átomo, analisam as seguintes afirmativas:
I. Átomos isótopos são aqueles que possuem mesmo número atômico e números de massa diferentes.
II. O número atômico de um elemento corresponde à soma do número de prótons com o de nêutrons.
III. O número de massa de um átomo, em particular, é a soma do número de prótons com o de elétrons.
IV. Átomos isóbaros são aqueles que possuem números atômicos diferentes e mesmo número de massa.
V. Átomos isótonos são aqueles que apresentam números atômicos diferentes, número de massas diferentes e mesmo número de nêutrons.
Esses estudantes concluem, corretamente, que as afirmativas verdadeiras são as indicadas por:
a) I, III e V
b) I, IV e V
c) II e III
d) II, III e V
e) II e V
10. (PUC-MG) O íon óxido O2- possui o mesmo número de elétrons que:
Dados: O (Z=8); F (Z=9); Na (Z=11); Ca (Z=20); S (Z=16);
a) o íon fluoreto F-.
b) o átomo de sódio Na.
c) o íon cálcio Ca2+
d) o íon sulfeto S2-
Aula 16
Semana 20/08
Organização da Tabela Periódica
Dmitri Ivanovich Mendeleev (1834-1907) foi considerado o “pai da Tabela Periódica”, pois em 1869 ele organizou os elementos químicos em filas horizontais em ordem crescente de massa atômica e mostrou que nas linhas verticais havia elementos com propriedades químicas e físicas semelhantes.
Foi o primeiro trabalho que conseguiu relacionar as propriedades periódicas (que se repetiam em intervalos regulares) dos elementos. Seu trabalho foi tão impressionante que Mendeleiev conseguiu até mesmo prever a existência de determinados elementos que ainda não haviam sido descobertos, onde eles ficariam na Tabela Periódica e quais seriam as suas propriedades.
No entanto, em 1913, o físico inglês Henry Moseley realizou experimentos com raios X e descobriu o número atômico (Z) dos elementos químicos, ou seja, a quantidade de prótons que há no núcleo dos átomos de cada elemento. Ele provou que as propriedades dos elementos tinham relação não com a massa atômica, como dizia Mendeleiev, mas sim com o número atômico.
Por isso, a Tabela Periódica atual é organizada em linhas horizontais em ordem crescente de número atômico. Tanto que o primeiro elemento químico que aparece da esquerda para a direita na parte superior é o hidrogênio, que é o elemento de menor número atômico, 1. Logo à sua direita vem o hélio, He, com número atômico igual a 2, depois vem o lítio, com número atômico igual a 3, seguido do berílio, Be, de número atômico igual a 4, e assim por diante.
Essa classificação crescente de números atômicos permite organizar os elementos em grupos ou famílias (colunas) que possuem propriedades semelhantes, além disso, as linhas horizontais também nos revelam particularidades a respeito dos átomos dos elementos. Observe como se dá essa organização:
Grupos ou famílias – Colunas:
As colunas são chamadas de grupos ou famílias. Esses nomes são bem apropriados, pois os membros de uma família possuem várias características físicas, emocionais e psicológicas semelhantes; além disso, os membros de um grupo específico possuem também objetivos e gostos similares. Da mesma forma, os elementos pertencentes a um mesmo grupo ou a uma mesma família da Tabela Periódica possuem propriedades físicas e químicas semelhantes.
Isso acontece porque os elementos químicos que estão em uma mesma família possuem a mesma quantidade de elétrons na camada de valência, isto é, na última camada eletrônica:
Família 1: Possuem todos 1 elétron na camada de valência;
Família 2: Possuem todos 2 elétrons na camada de valência;
Família 13: Possuem todos 3 elétrons na camada de valência;
Família 14: Possuem todos 4 elétrons na camada de valência;
Família 15: Possuem todos 5 elétrons na camada de valência;
Família 16: Possuem todos 6 elétrons na camada de valência;
Família 17: Possuem todos 7 elétrons na camada de valência;
Família 18: Possuem todos 8 elétrons na camada de valência.
Segundo a IUPAC (União Internacional da Química Pura e Aplicada), atualmente as famílias da Tabela Periódica devem ser ordenadas de 1 a 18. Algumas dessas famílias possuem nomes especiais, que são muito usados:
Família 1: Metais alcalinos;
Família 2: Metais alcalinoterrosos;
Família 16: Calcogênios;
Família 17: Halogênios;
Família 18: Gases Nobres.
Organização das famílias da tabela periódica
Ainda hoje existem Tabelas Periódicas que usam a numeração antiga, que usava números acompanhados das letras “A” ou “B”. Essas letras eram usadas para representar mais alguns subgrupos dos elementos, que são: elementos representativos e elementos de transição (externa e interna).
Elementos representativos: Antigamente eram todos os membros das famílias que tinham o número acompanhado da letra “A” (1A, 2A, 3A, 4A, 5A, 6A, 7A e 8A). Hoje eles estão nas famílias 1, 2, 13 a 18. São os elementos mais importantes da Tabela Periódica e são os mais estudados no Ensino Médio. Todos os elementos representativos possuem o seu elétron mais energético situado nos subníveis “s” ou “p”.
Elementos de transição: Antigamente eram todos os membros das famílias que tinham o número acompanhado da letra “B” (1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B), mas hoje são os membros das famílias 3 a 12. Esses elementos estão representados na região central da Tabela. Todos os elementos de transição possuem o seu elétron mais energético situado nos subníveis “d” ou “f”.
– Elementos de transição externa:São aqueles que estão expostos regularmente como os demais elementos na Tabela Periódica. Eles estão representados na região central da Tabela. Seus elétrons mais energéticos ficam no subnível “d”.
– Elementos de transição interna:Esses elementos estão abaixo do corpo principal da Tabela e são duas séries: a série dos lantanídeos e a série dos actinídeos.Seus elétrons mais energéticos ficam no subnível “f”.
Elementos representativos e de transição na Tabela Periódica
Períodos – Linhas:
As sete linhas horizontais que aparecem na Tabela Periódica são os períodos e indicam a quantidade de camadas eletrônicas que os átomos de tais elementos possuem. Por exemplo, todos os elementos do primeiro período (primeira linha) da Tabela Periódica possuem apenas uma camada eletrônica, a camada K; enquanto isso, todos os elementos do segundo período têm duas camadas eletrônicas, as camadas K e L, e assim por diante.
Organização dos períodos da tabela periódica
Nomes especiais na Tabela Periódica
A tabela periódica é formada por 7 linhas (linhas horizontais) e 18 grupos ou famílias (linhas verticais). Algumas regras têm nomes especiais:
# Grupo 1 (Li, Na, K, Rb, Cs, Fr) —————————–> Metais Alcalinos
O nome alcalino vem do árabe alcalino, que significa cinzas de plantas. O seja e o potássio (os primeiros elementos descobertos do grupo) foram encontrados nas cinzas de alguns produtos queimados.
Sódio
Esta página foi retirada do site http://www.infoescola.com
# Grupo 2 (Seja, Mg, Ca, Sr, Ba, Rá) ————————-> Metais Alcalinos-Terrosos
Eles são capazes de ter algumas bases com os metais alcalinos (formam bases de Arrhenius, por exemplo). Já o termo terroso refere-se a existir na terra. Além disso, seus óxidos foram chamados por muito tempo de terra.
Magnésio
Esta foto foi retirada do site http://www.rima.com.br
# Grupo 16 (O, S, Se, Te, Po) ——————————–> Calcogênios
A palavra khalkos vem do grego e significa “formadores de cobre”. Alguns minérios de cobre podem ser utilizados como fonte de informação (calcopirita, CuFeS2, por exemplo).
Enxofre
Esta página foi retirada do site http://www.lookfordiagnosis.com
# Grupo 17 (F, Cl, Br, I, At) ———————————— > Halogênios
A palavra halogênio vem do grego e significa “formadores de sais”. O sal de cozinha (NaCl), por exemplo, possui halogênio em sua composição.
Cloro
Esta foto foi retirada do site http://www.quimlab.com.br
# Grupo 18 (Ele, Ne, Ar, Kr, Xe, Rn) ————————-> Gases Nobres
Eles recebem esse nome porque são pequenos reativos. São gases monoatômicos que, durante muito tempo, foram chamados de inertes, até o momento em que foram comprovados outros compostos (XeF4, por exemplo).
Criptônio
Esta foto foi retirada do site http://www.quimlab.com.br
Propriedades Periódicas
As propriedades periódicas dos elementos químicos são as características que eles possuem.
Note que os elementos químicos da tabela periódica tem um local específico que varia de acordo com as propriedades periódicas que apresentam. Eles estão ordenados por ordem crescente de número atômico.
Segundo a Lei de Moseley:
“Muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência do números atômicos dos elementos.”
Principais Propriedades Periódicas
Raio Atômico
Relacionada com o tamanho dos átomos, essa propriedade é definida pela distância entre os centros dos núcleos de dois átomos do mesmo elemento.
Sendo assim, o raio atômico corresponde à metade da distância entre os núcleos de dois átomos vizinhos, sendo expresso da seguinte maneira:
r = d/2
Onde:
r: raio
d: distância internuclear
Ele é medido em picômetros (pm). Essa medida é um submúltiplo do metro:
1 pm = 10-12 m
Na tabela periódica, o raio atômico aumenta de cima para baixo na posição vertical. Já na horizontal, eles aumentam da direita para esquerda.
Variação do Raio Atômico
O elemento químico que possui maior raio atômico é o Césio (Cs).
Volume Atômico
Essa propriedade periódica indica o volume ocupado por 1 mol do elemento no estado sólido.
Vale notar que o volume atômico não é o volume de 1 átomo, mas um conjunto de 6,02 . 1023 átomos (valor de 1 mol)
O volume atômico de um átomo é definido não somente pelo volume de cada átomo, mas também o espaçamento que existe entre esses átomos.
Na tabela periódica, os valores do volume atômico aumentam de cima para baixo (vertical) e do centro para as extremidades (horizontal).
Variação do Volume Atômico
Para calcular o volume atômico, utiliza-se a seguinte fórmula:
V = m/d
Onde:
V: volume atômico
m: massa de 6,02 . 1023 átomos do elemento
d: densidade do elemento no estado sólido
Densidade Absoluta
A densidade absoluta, também chamada de “massa específica”, é uma propriedade periódica que determina a relação entre a massa (m) de uma substância e o volume (v) ocupado por essa massa.
Ela é calculada pela seguinte fórmula:
d = m/v
Onde:
d: densidade
m: massa
v: volume
Na tabela periódica, os valores das densidades aumentam de cima para baixo (vertical) e das extremidades para o centro (horizontal).
Variação da Densidade Absoluta
Assim, os elementos mais densos estão no centro e na parte inferior da tabela:
Ósmio (Os): d= 22,5 g/cm3
Irídio (Ir): d = 22,4 g/cm3
Ponto de Fusão e Ponto de Ebulição
Outra importante propriedade periódica está relacionada com as temperaturas nas quais os elementos entram em fusão e ebulição.
O Ponto de Fusão (PF) é a temperatura onde a matéria passa da fase sólida para a fase líquida. Já o Ponto de Ebulição (PE) é a temperatura onde a matéria passa da fase líquida para a gasosa.
Na tabela periódica, os valores de PF e de PE variam segundo os lados que estão posicionados na tabela.
No sentido vertical e no lado esquerdo da tabela, eles aumentam de baixo para cima. Já do lado direito, eles aumentam de cima para baixo. No sentido horizontal, eles aumentam das extremidades para o centro.
Variação do Ponto de Fusão e Ebulição
Afinidade Eletrônica
Também chamada de “eletroafinidade”, trata-se da energia mínima necessária de um elemento químico com o intuito da retirada de um elétron de um ânion.
Ou seja, a afinidade eletrônica indica a quantidade de energia liberada no momento em que um elétron é recebido por um átomo.
Observe que esse átomo instável se encontra sozinho e no estado gasoso. Com essa propriedade, ele adquire estabilidade quando recebe o elétron.
Em contraposição ao raio atômico, a eletroafinidade dos elementos da tabela periódica cresce da esquerda para a direita, na horizontal. Já no sentido vertical, ele aumenta de baixo para cima.
Variação da Afinidade Eletrônica
O elemento químico que possui maior afinidade eletrônica é o Cloro (Cl), com o valor de 349 KJ/mol.
Energia de Ionização
Também chamado de “potencial de ionização”, essa propriedade é contrária à de afinidade eletrônica.
Trata-se da energia mínima necessária de um elemento químico com o intuito de retirar um elétron de um átomo neutro.
Desse modo, essa propriedade periódica indica qual a energia necessária para transferir o elétron de um átomo em estado fundamental.
O chamado “estado fundamental de um átomo” significa que o seu número de prótons é igual ao seu número de elétrons (p+ = e-).
Com isso, após a retirada de um elétron do átomo, ele é ionizado. Ou seja, ele fica com mais prótons do que elétrons, e, portanto, se torna um cátion.
Na tabela periódica, a energia de ionização é contrária à do raio atômico. Assim, ela aumenta da esquerda para a direita e de baixo para cima.
Variação da Energia de Ionização
Os elementos que possuem maior potencial de ionização são o Flúor (F) e o Cloro (Cl).
Eletronegatividade
Propriedade dos átomos dos elementos os quais possuem tendências em receber elétrons numa ligação química.
Ela ocorre nas ligações covalentes no momento do compartilhamento de pares de elétrons. Ao receber elétrons, os átomos ficam com uma carga negativa (ânion).
Lembre-se que esta é considerada a propriedade mais importante da tabela periódica. Isso porque a eletronegatividade induz o comportamento dos átomos, a partir do qual são formadas as moléculas.
Na tabela periódica, a eletronegatividade aumenta da esquerda para a direita (no sentido horizontal) e de baixo para cima (no sentido vertical)
Variação da Eletronegatividade
Sendo assim, o elemento mais eletronegativo da tabela periódica é o Flúor (F). Por outro lado, o Césio (Cs) e Frâncio (Fr) são os elementos menos eletronegativos.
Eletropositividade
Ao contrário da eletronegatividade, essa propriedade dos átomos dos elementos indica as tendências em perder (ou ceder) elétrons numa ligação química.
Ao perder elétrons, os átomos dos elementos ficam com uma carga positiva, formando assim, um cátion.
No mesmo sentido do raio atômico e contrário a eletronegatividade, na tabela periódica a eletropositividade aumenta da direita para a esquerda (horizontal) e de cima para baixo (vertical).
Variação da Eletropositividade
Os elementos químicos de maior eletropositividade são os metais, e por isso, essa propriedade é também denominada de “caráter metálico”. O elemento mais eletropositivo é o Frâncio (Fr) com tendência máxima à oxidação.
Atenção!
Os “gases nobres” são elementos inertes, pois não realizam ligações químicas e dificilmente doam ou recebem elétrons. Além disso, eles possuem dificuldades em reagir com outros elementos.
Sendo assim, a eletronegatividade e eletropositividade desses elementos não são consideradas.
Leia também:
Ligações Químicas
História da Tabela Periódica
Propriedades Aperiódicas
Além das propriedades periódicas, temos as aperiódicas. Nesse caso, os valores aumentam ou diminuem com o número atômico dos elementos.
Recebem esse nome, pois não obedecem à posição na tabela periódica como as periódicas. Ou seja, elas não se repetem em períodos regulares.
As principais propriedades aperiódicas são:
Massa Atômica: essa propriedade aumenta conforme o aumento do número atômico.
Calor Específico: essa propriedade diminui com o aumento do número atômico. Lembre-se que o calor específico é a quantidade de calor necessária para aumentar a temperatura de 1 °C de 1g do elemento.
Exercícios de Vestibular com Gabarito
1. (PUC-RJ) Considere as afirmações sobre elementos do grupo IA da Tabela Periódica
I. São chamados metais alcalinos.
II. Seus raios atômicos crescem com o número atômico.
III. Seu potencial de ionização aumenta com o número atômico.
IV: Seu caráter metálico aumenta com o número atômico.
Dentre as afirmações, são verdadeiras:
a) I e II
b) III e IV
c) I, II e IV
d) II, III e IV
e) I, II, III e IV
Alternativa c
2. (UFMG) Comparando o cloro e o sódio, os dois elementos químicos formadores do sal de cozinha, pode afirmar que o cloro:
a) é mais denso.
b) é menos volátil.
c) tem maior caráter metálico.
d) tem menor energia de ionização.
e) tem menor raio atômico.
Alternativa e
3. (UFC-CE) O efeito fotoelétrico consiste na emissão de elétrons provenientes de superfícies metálicas, através da incidência de luz de frequência apropriada. Tal fenômeno é diretamente influenciado pelo potencial de ionização dos metais, os quais têm sido largamente utilizados na confecção de dispositivos fotoeletrônicos, tais como: fotocélulas de iluminação pública, câmeras fotográficas etc. Com base na variação do potencial de ionização dos elementos da Tabela Periódica, assinale a alternativa qu contém o metal mais suscetível a exibir o efeito fotoelétrico.
a) Fe
b) Hg
c) Cs
d) Mg
e) Ca
VEJA TAMBÉM: História da Tabela Periódica
Aula 17
Semana 27/08
Símbolos e Fórmulas
São conhecidos atualmente mais de 100 elementos químicos. Cada um deles tem um nome e um símbolo diferente.
Os símbolos são a representação dos elementos químicos.
São formados por uma, duas ou três letras.
A primeira é sempre maiúscula e a segunda, é sempre minúscula.
O símbolo de um elemento vem de uma ou duas letras tiradas de seu nome em latim. Por causa disso, nem todos os símbolos têm relação lógica com o nome do elemento em português.
Os que têm três letras não têm nomes oficiais, atribuídos pela Iupac (União Internacional de Química Pura e Aplicada).
Fórmula Química
Todas as substâncias são formadas por átomos. As substâncias simples são formadas por átomos de um único elemento e as substâncias compostas são formadas por átomos de dois ou mais elementos diferentes.
As moléculas são as menores unidades que apresentam a composição característica de uma substância. As moléculas são formadas pela união de dois ou mais átomos.
Para representar graficamente as moléculas de uma substância, seja ela simples ou composta, os químicos utilizam fórmulas. A fórmula da água é H2O. Outras fórmulas usadas pelos químicos são CO2 (gás carbônico), N2(gás nitrogênio), O2 (gás oxigênio), O3 (gás ozônio), C2H6O (etanol), C6H12O6 (glicose), NH3 (amônia) eH2SO4 (ácido sulfúrico).
Na fórmula de uma substância são colocados os símbolos dos elementos que tornam parte de sua composição e os índices de atomicidade (ou, simplesmente, atomicidade), que indicam a proporção em que os átomos do elemento estão presentes na substância. Se o índice de atomicidade não for escrito, é porque seu valor é 1.
Uma fórmula química é uma representação de um composto químico, ou seja, de uma molécula.
Exemplos:
1) A molécula de água é representada da seguinte forma:
temos 2 átomos de hidrogênio e 1 átomo de oxigênio, então sua fórmula química será H20
2) O dióxido de carbono é representado da seguinte forma:
temos 1 átomo de carbono e 2 átomos de oxigênio. então sua fórmula química será CO2
Exercícios sobre formula química
Atividade formula química
1) A Fórmula química da amônia é:
a) ( ) NH
b) ( )N1H2
c) ( ) NH3
d) ( )N2H 2
2) O sal de cozinha, conhecido com cloreto de sódio possuem qual fórmula química:
a) ( ) ClNa
b) ( ) NaCl
c) ( ) ClSo
d)( ) NaCl3 3)
3) Qual o nome dos compostos que possuem as seguintes fórmulas químicas respectivamente, HCl, NaOH, KCl, CaO:
a) ( ) Cloreto de Potássio, Ácido clorídrico, Hidróxido de sódio, Cloreto, Óxido de cálcio.
b) ( ) Hidróxido de sódio, Cloreto, Óxido de cálcio, Cloreto de Potássio, Ácido clorídrico,
c) ( ) Ácido clorídrico, Hidróxido de potássio, Cloreto de sódio, Óxido de cálcio.
d) ( ) Ácido clorídrico, Hidróxido de sódio, Cloreto de Potássio, Óxido de cálcio.
Fonte: Caderno do Professor: Ciências, Ensino Fundamental – 9º Ano, Volume 1. São Paulo: SEE, 2009.
Aula 18
Semana 09/08
Massa atômica
Em química, a massa de um átomo é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do isótopo 12C (carbono 12). Na unidade comum, corresponde a 1,6605402 x 10-27 kg.
Os valores da massa atômica de cada elemento é tabelado e podem ser conferidos em uma tabela periódica.
Exemplo 1:
Qual a massa atômica do Hidrogênio, do oxigênio?
Massa molecular
É dada pela soma das massas atômicas de todos os átomos de uma molécula.
Exemplo:
1) Para a molécula C6H12O6 (glicose), a massa molecular é :
6 átomos de carbono = 6 x 12,01 u = 72,06 u.
12 átomos de hidrogênio = 12 x 1,00 u = 12,00 u.
6 átomos de oxigênio = 6 x 15,99 = 95,94 u.
Somando (72,06u)+(12,00u)+(95,94u) = 179,04u que é a massa molecular da glicose.
Exercícios
1 ) A Massa atômica:
a) ( ) é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do isótopo 14C (carbono 14).
b) ( ) é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do isótopo 12C (carbono 12).
c) ( ) é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do cloro (cloro 12).
d) ( ) é a massa de um átomo expressa em u. Que indica quantas vezes à massa do átomo é maior que 1/12 da massa de 14C.
2) Com auxilio de uma tabela periódica ache as massas atômicas dos seguintes elementos, Oxigênio, Hidrogênio, Nitrogênio, carbono, Sódio, cálcio, cloro e enxofre, seus valores são respectivamente:
a) ( ) 16, 2, 14, 12, 25, 40, 37,5 e 32.
b) ( ) 16, 1, 14, 4, 23, 40, 35,5 e 32.
c) ( ) 16, 1, 14, 12, 23, 40, 35,5 e 32.
d) ( ) 16, 1, 14, 12, 23, 40, 32 e 35,5.
3) Qual a massa atômica das seguintes moléculas:
a) NaCl
b) H2O
c) NaOH
d) HCl
e) NH3
f) C2H6O
Aula 19
Semana 17/09 a 15/10
Equação química
A equação química é a forma de se descrever uma reação química. Os reagentes são mostrados no lado esquerdo da equação e os produtos no lado direito.
Exemplo: a reação de síntese da amônia.
Ao analisar a reação nota-se que uma molécula nitrogênio (N2) reage com 3 moléculas de hidrogênio (H2) para formar 2 moléculas de amônia (NH3).
Lei de Lavoisier ( Lei da conservação das massas)
Num sistema fechado, quando duas ou mais substâncias reagem entre si, a massa total dos produtos é igual a soma das massas das substâncias reagentes.
“Na natureza nada se cria, nada se perde; tudo se transforma”
Massa dos reagentes = Massa dos produtos
Exemplos:
1) Considerando um sistema fechado a reação química:
Temos 5g de A e 10g de B, a massa total dos reagente é 15g.
De acordo com a lei de Lavoisier a massa total dos produtos será 15g.
2) Se em uma reação:
Massa de A = 10g
Massa de B = 30g
Massa de D = 12g
Qual é a massa de C?
De acordo com a lei de Lavoisier:
“massa dos reagentes = massa dos produtos”
Massa dos reagentes = A + B = 10g + 30g =40g
Massa dos produtos = C + D = C + 12g
40g = C + 12g
C = 28g
Lei de Proust
As massas dos reagentes e as massas dos produtos que participam de uma reação obedecem sempre a uma proporção constante. Essa proporção é característica de cada reação, isto é, independe da quantidade de reagentes utilizados.
Exemplo:
1) Para a reação entre o hidrogênio e oxigênio formando água, os seguintes valores experimentais podem ser obtidos:
Hidrogênio(g)
Oxigênio(g)
Água(g)
10
80
90
2
16
18
1
8
9
0,4
3,2
3,6
Observa-se que a massa do produto é igual à soma da massa dos reagentes, o que concorda com a Lei de Lavoisier.
As massas dos reagentes e dos produtos que participam de uma reação química podem ser diferentes, mas as relações entre elas são sempre constantes, Consequências da Lei de Proust, como pode ser conferido na tabela abaixo:
mO/mH = massa do oxigênio dividido pela massa do hidrogênio.
mágua/mH = massa da água dividido pela massa do hidrogênio.
mágua/mO = massa da água dividido pela massa do oxigênio.
Lei de G-Lussac
“Os volumes de todas as substâncias gasosas envolvidas em um processo químico estão entre si em uma relação de números inteiros e simples, desde que medidos à mesma temperatura e pressão”.
1 L de H2 + 1 L de Cl2 = 2 L de HCl
Relação de números inteiros e simples: 1:1:2
Cabe aqui observar que nem sempre a soma dos volumes dos reagentes é igual à dos produtos. Isso quer dizer que não existe lei de conservação de volume, como ocorre com a massa.
10 L de H2 + 5 L de O2 = 10 L de H2O
Relação de números inteiros e simples: 10:5:10,que pode ser simplificada por 2:1:2
Nas CNTP, o volume molar é igual a 22,4 L/mol.
Exemplo:
1) A reação de síntese da amônia, considerando a temperatura e a pressão constante.
Nota-se que para a reação ocorrer é necessário 1L de N2 e 3L de H2 para formar 2L de NH3 ( amônia).
Aula 18
Balanceamento por tentativa
Em uma reação química os números colocados antes da fórmula de cada substância, seja reagente ou produto, são chamados de coeficientes estequiométricos ou simplesmente, coeficientes. Estes informam a proporção entre as quantidades em mols dos participantes de uma dada reação química.
Exemplo, para se formar uma molécula de água:
Os números em vermelhos,são os coeficientes, e indicam que para se forma uma molécula de água é necessário se ter 1 molécula de Hidrogênio (1 H2) e meia molécula de Oxigênio (1/2 O2 )
Quando escrevemos uma equação química, ela deve estar corretamente balanceada, ou seja, os coeficientes devem estar corretamente indicados. Caso contrário, não estará observando o fato de os átomos se conservarem e com a proporção errada a reação não ocorerá.
Uma forma de se balancear uma reação química é pelo método de tentativas, que constitui dar valores arbitrários aos coeficientes estequiométrico de modo a tentar igualar os números de átomos dos reagentes e dos produtos.
Exemplo:
A combustão do etanol (C2H6O), álcool combustível, produz gás carbônico e água. A reação está representada a seguir:
Vamos analisar o número de átomos nos reagente e nos produtos:
Nota-se que os números dos átomos carbonos dos reagentes (CR) e dos carbonos dos produtos (CP) são diferentes, e o mesmo se nota nos hidrogênios dos produtos (HP) e dos reagentes (HR).
Para que a reação ocorra é necessário fazer o balanceamento ( obs: sempre deixe o Oxigênio para ser balanceado no final ).
– Vamos fazer por etapas;
1°) Balancear o Carbono
– Observe que nos reagentes temos 2 Carbonos e nos produtos temos 1 Carbono, como podemos igualar:
2 C = x 1C
– Qual valor multiplicado por 1 dará 2? (sempre o coeficiente menor é multiplicado)
x = 2
O valor de “X” será o coeficiente do carbono do produto
Agora vamos balancear o hidrogênio
2°) Balancear o Hidrogênio
– Observe que temos 6 Hidrogênios no reagentes e 2 Hidrogênios nos produtos
– Qual valor multiplicado por 2 dará 6 ? (sempre o coeficiente menor é multiplicado)
6H = y2H
y = 3
O valor de “y” será o coeficiente do hidrogênio do produto.
ATENÇÃO: Note que a quantidade de oxigênio foi alterada devido ao balanceamento dos produtos, agora temos:
Se colocarmos um coeficiente no C2H6O vai ser alterado toda a reação então o coeficiente é colocado no O2
3°) – Então qual valor multiplicado por 2 dará 6 ? ( lembrando que já se tem um Oxigênio no C2H6O)
2z = 6
Z = 3 coeficiente do O2
Agora vamos ver se o balanceamento esta correto:
Os números dos átomos dos produtos e dos reagentes estão iguais, com isso a reação está balanceada.
Balanceamento resumido
Balanceamento
1) As equações a seguir são de reações de deslocamento entre ametais, e não
estão balanceadas, então forneça os coeficiente que tornem as equações
balanceadas.
a) Cl2 + HI → HCl + I2
b) F2 CaCl → CaF2 + Cl2
c) Br2 + H2S → HBr + S8
2) Forneça os coeficientes que torne a equações balanceadas.
a) Na2O + HCl → NaCl + H2O
b) SO2 + NaOH → Na2SO3 + H2O
c) N2O4 + H2O → HNO2 + HNO3
3) complete as equações químicas com os coeficiente que faltam para
balancear a equação.
a) 1 CaH2 + __ H2O → __ Ca(OH)2 + 2 H2
b) __ CH2O + 1 O2 → __ CO2 + 1 H2O
c) __ C4H8O2 + __ O2 → 4 CO2 + __ H2O
d) ___ (NH4)3PO4 + 3 BaBr2 → 1 Ba3(PO4)2 + ___ NH4Br
Aula 19
Estequiometria
Se em uma reação química é conhecido a quantidade de reagente (ou reagentes) pode-se calcular a quantidade de produtos formados.
Se em uma reação química a quantidade de produto formado (ou produtos) é conhecida pode se calcular a quantidade de regentes consumidos.
Em geral, as reações químicas combinam proporções definidas de compostos químicos. Já que a matéria não pode ser criada ou destruída, a quantia de cada elemento deve ser a mesma antes, durante e após a reação, ou seja, a quantidade de produtos tem que ser iguais às quantidades de reagentes. E a estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Regra geral para a estequiometria
1° Escrever a equação química do processo.
2° Fazer o balanceamento da equação química.
3° Montar as proporções baseando-se nos dados e nas perguntas do problema.
4°Utilizar regras de três para chegar à resposta.
Exemplos
1) A reação de formação da água é:
– Qual a quantidade em grama de oxigênio e de hidrogênio necessário para se ter 72g de H2O?
1° Montar a reação química
2° Balancear a equação
3° montar as proporções
4° fazer regra de 3
Para se ter 72g de água será preciso reagir 8g de hidrogênio com 64g de Oxigênio.
Fonte: https://quimik.webnode.com.br
Aula 20
Semana 15/10
SITUAÇÃO DE APRENDIZAGEM 5 QUANTIDADE DE MATÉRIA E SUA UNIDADE (MOL)
Mol
É usado para relacionar a quantidades de matérias, de substâncias. Seu uso é comum para simplificar representações de proporções químicas e no cálculo de concentração de substâncias.
Podemos fazer uma analogia com a “dúzia” que também é utilizada para descrever quantidades.
Exemplo:
Se eu falar que tenho uma dúzia de balas, eu terei 12 balas. Com o mol é a mesma idéia só que o valor não será 12(doze), mas uma quantidade de 6,022×1023 do que estiver sendo relacionado.
Simplificando
1 dúzia = 12 quantidades
1mol = 6,022x1023quantidades
Então Se em vez de eu dizer que tenho uma dúzia de balas eu falar que tenho 1(um) mol de bala, quer dizer que eu tenho 6,022×1023 balas,Para se calcular a quantidade de mol de uma molécula usa-se a seguinte formula:
Exemplos:
1) Tenho 60g de água (H2O), qual a quantidade de mols?
Primeiramente tem que se calcular a massa molecular da água:
H = 1u
O = 16u
Então a massa molecular vai ser: 2x(1u) + (16u) = 18u
Colocando esse valor na formula, teremos:
Massa molar
Está relacionada com a constante de Avogadro, e o seu valor numérico é o mesmo que a massa molecular, mas a unidade passa a ser gramas por mol (g/mol).
Exemplo:
1) A massa molecular da glicose (C6H12O6) é de 179,04u, qual é a sua massa molar?
Como a massa molar e a molecular tem o mesmo valor, o que vai mudar é a unidade, ou seja, a massa molar será de 179,04g/mol
Significa que para se ter 1 mol de glicose é preciso 179,04g.
Constante de Avogadro
Pela definição, pode-se concluir que 1 mol de qualquer elemento terá sempre o mesmo número de partículas. Esse número é denominado constante de Avogadro (NA) que, com aproximação de 4 dígitos, é igual a 6,022 1023 partículas por mol.
Exercícios
1) Em 72g de água qual a quantidade de mol?
2) Se tem 400g de NaOH qual é a quantidade de mol?
3) Sabe-se que a massa atômica de um elemento Z é igual a 240 u e sua se tem 38,4 g deste elemento, então qual será a quantidade de mol?
a) ( ) 0,166
b) ( ) 0,10
c) ( ) 16
d) ( ) 0,16
e) ( ) 166
4) uma dúzia corresponde a 12 unidades e 1 Mol corresponde á:
a) ( ) 1000000 unidades
b) ( ) 6,023 x1023 unidades
c) ( ) 6,023×1063 unidades
d) ( ) 8,023×1023 unidades
Aula 20
Semana 15/10
SITUAÇÃO DE APRENDIZAGEM 6
PREVISÃO DAS QUANTIDADES DE REAGENTES E DE
PRODUTOS NAS TRANSFORMAÇÕES QUÍMICAS
Nesta Situação de Aprendizagem, você terá condições de prever, nas transformações químicas,
as quantidades de reagentes a ser utilizadas e as de produtos a ser obtidas. Nas indústrias, esse cálculo
é essencial para não haver desperdício de matéria-prima e para prever quanto será produzido
na transformação.
Atividade 1 – Prevendo quantidades envolvidas nas transformações químicas:
relação entre massa e quantidade de matéria
Exercícios em sala de aula
1. Observe a representação da combustão do gás hidrogênio (H2) e complete a tabela, indicando o
nome das substâncias e a quantidade de matéria, em mol, de cada uma delas.
2 H2(g) + O2(g) → 2 H2O(g)
Nome das substâncias
Quantidade de matéria em mol 2 mol
2. Observe novamente a equação anterior, considerando a proporção entre reagentes e produtos, e
responda:
a) Se pretendermos obter 8 mol de água, qual deverá ser a quantidade de matéria utilizada,
em mol, de gás hidrogênio? E a de gás oxigênio?
b)Ao utilizarmos 6 mol de gás hidrogênio, qual será a quantidade de matéria necessária,
em mol, de gás oxigênio? Que quantidade de matéria, em mol, de água será formada?





