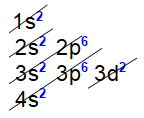DISCIPLINA: QUÍMICA – 2° SÉRIE – 1° BIMESTRE.CRONOGRAMA DE ATIVIDADES
Aula 11ª semanaAcordo Pedagógico.Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania. |
| O QUE PRECISO FAZER? Trazer o caderno do aluno em todas as aulas. Ler o texto em casa. Tentar responder às Questões durante a semana, Assistir vídeo aulas. Na sala de aula faremos discussão do texto e responder as questões do texto, se necessário tirar as dúvidas. |
| ESTRATÉGIAS
Desenvolve aulas a partir de um levantamento prévio do conhecimento dos alunos, solicita pesquisas sobre o tema para introduzir o conteúdo utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apoia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros. |
| RECURSOS
Conteúdos retirados de livros didáticos, apostilas, pesquisas, vídeos, exemplos e experimentos.Análise de situações do cotidiano e suas relações com os conteúdos trabalhados.Livro Didático (Química na abordagem do cotidiano), Caderno do aluno. AVALIAÇÃO |
| RECUPERAÇÕES DA APRENDIZAGEM
O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma |
Aula 2
Semana 05/02/2018 a 09/02/2018
Situação de Aprendizagem 1 – Propriedades da água para o consumo humano. Conceitos de pureza e potabilidade.
Competência e habilidades. Fazer uso da linguagem química para expressar conceitos relativos a pureza das concentrações de solutos em sistemas líquidos; interpretar dados apresentados em tabelas gráficos concernentes ao critério brasileiro de potabilidade da água; aplicar conceitos de concentração para avaliar a qualidade de diferentes águas; reconhecer como algumas propriedades específicas da água possibilitam a vida no planeta.
O planeta Terra possui cerca de 71% de sua superfície recoberta por água. Desse total, cerca de 97,5% da água é salgada e apenas 2,5% são de água doce, que é a utilizada para consumo humano. Entretanto, nem toda água doce está disponível para uso, uma vez que grande parte está no estado sólido em geleiras e calotas polares. Do total de 2,5%, apenas 0,77% está disponível, porém nem sempre atende às especificações para ser considerada potável.
Água potável
A água potável é aquela que pode ser consumida pelo homem sem que haja nenhum prejuízo à saúde.
A água potável pode ser definida como a água própria para consumo, ou seja, livre de substâncias e organismos que possam trazer doenças, além de não possuir cor, gosto, ou cheiro. Para que uma água seja considerada potável, devemos, portanto, analisar suas características físicas, químicas, biológicas e até mesmo radioativas.
Muitas pessoas pensam que a água cristalina é potável e que, portanto, não necessita de tratamento. Entretanto, apenas cor e odor não são suficientes para garantir que a água seja própria para o consumo, haja vista que organismos patogênicos microscópicos podem estar presentes e causar sérios danos à saúde. Sendo assim, a água potável não pode ser avaliada apenas visualmente, sendo fundamentais os testes de potabilidade.
Normalmente águas de rios e lagos não são próprias para consumo humano, sendo fundamental que passem por processos específicos em estações de tratamento de água. Após o tratamento, é importante que sejam realizados testes para confirmar se a água tratada corresponde ao padrão de potabilidade exigido pelo Ministério da Saúde. Caso esteja de acordo, a água poderá ser enviada para a população.
Dentre os padrões exigidos pelo Ministério da Saúde, destacam-se a análise dos coliformes fecais, monitoramento de Escherichia coli, análise da turbidez e das substâncias químicas presentes, incluindo-se as cianotoxinas e verificação de ph, gosto, odor e radioatividade.
A Organização Mundial de Saúde estima que cerca de 748 milhões de pessoas não possuam acesso de forma sustentada à água potável no mundo e aproximadamente 1,8 bilhão de pessoas utilizem água contaminada. Isso significa que uma grande parcela da população está sujeita a contrair doenças que podem, inclusive, levá-las à morte.
A falta de água potável no Brasil e no mundo apresenta diversas causas, destacando-se a poluição e a falta de planejamento na distribuição desse recurso. Sendo assim, é importante que políticas sejam criadas urgentemente para garantir a conservação dos corpos hídricos, a despoluição de rios e que a distribuição ocorra de maneira adequada. Também é fundamental o investimento constante em saneamento, pois este garante um destino adequado ao esgoto e que água de qualidade chegue à população.
É importante destacar que a água potável é um bem valioso que merece atenção não só por parte dos governantes. Cada pessoa, ao desperdiçar água em sua casa ou poluir um rio, por exemplo, está contribuindo para que a quantidade de água potável seja reduzida.
Fazer a nossa parte é garantir qualidade de vida para a nossa geração e para as gerações futuras.
Água contaminada
A água contaminada pode ser definida como uma água poluída que provoca danos à saúde.

A água poluída pode causar doenças, sendo, nesse caso, chamada de água contaminada
É comum ouvirmos pessoas dizerem que a água de determinado local pode trazer doenças em virtude da quantidade de poluição nela presente. Entretanto, uma água poluídaé aquela que apresenta alterações na cor, no sabor e no cheiro, todavia, nem sempre ela provoca doenças.
Denominamos deágua contaminadaaquela que é capaz de colocar em risco a saúde da população graças à presença de agentes patogênicos, tais como bactérias e protozoários, e substâncias tóxicas, como metais pesados. Essa água, diferentemente da potável, não deve ser utilizada para consumo humano e nem mesmo para fins recreativos.
A contaminação da água pode ocorrer de várias maneiras, destacando-se a poluição por esgoto, metais pesados, agrotóxicos e fertilizantes. Todos esses tipos de contaminação ocorrem principalmente como consequência do descarte inadequado dessas substâncias e por acidentes que poderiam ser evitados se fossem seguidas as regras básicas de segurança.
Dentre as principais doenças desencadeadas pela água contaminada, destaca-se a diarreia. Todos os anos, milhões de pessoas, principalmente crianças, morrem em consequência dessa doença provocada pelo consumo de água imprópria para consumo. O maior número de mortes encontra-se entre pessoas de baixa renda, em virtude, muitas vezes, de saneamento básico precário. Além da diarreia, outras doenças que podem ser transmitidas pela água contaminada são a giardíase, leptospirose, cólera e febre tifoide.
Além dos problemas causados por organismos patogênicos, a água contaminada por substâncias químicas, como metais pesados e agrotóxicos, pode desencadear sérios danos à saúde. Esses contaminantes provocam envenenamento, desencadeiam danos ao sistema nervoso, fígado e rins e podem provocar até mesmo câncer.O grande número de mortes como resultado de água contaminada poderia ser evitado com projetos eficientes de saneamento básico.
É importante que ocorra uma maior fiscalização no que diz respeito ao descarte de substâncias químicas, uso de fertilizantes e tratamento de esgoto antes de seu lançamento nos rios. Também é essencial que a água seja tratada e testada antes de seu envio para a população.
Ao criar políticas que evitem a contaminação de água, estamos ajudando no abastecimento da cidade, pois mais água de qualidade estará disponível para a população. Além disso, contribuímos para manter a cidade limpa, prevenimos e controlamos doenças e promovemos melhores hábitos de higiene.
Classificação da água
Dentre as formas de classificação da água, destaca-se a que considera o grau de salinidade, sendo reconhecidos três tipos distintos: água doce, salgada e salobra.

A água própria para o consumo é doce e potável
Ao pensarmos em água, é comum nos lembrarmos apenas daquela usada no nosso dia a dia. Entretanto, a água apresenta características que permitem classificá-la em diferentes tipos.
Uma das principais classificações é baseada na salinidade da água, ou seja, na quantidade de sal dissolvida. Segundo essa classificação, possuímos três tipos de água: doce, salobra e salgada.
A água salgada é aquela que apresenta alta concentração de sal, principalmente cloreto de sódio, e salinidade igual ou superior a 30%. Ela é o principal tipo de água encontrado no planeta, representando cerca de 97,5% do total.
A água salobra é aquela que não apresenta uma quantidade de sal elevada como a água salgada, mas não possui a mesma quantidade de sal da água doce. Essa água, que possui salinidade entre 0,5% e 30,5%, poderia ser considerada um meio-termo entre a água salgada e a doce. Esse tipo é encontrado principalmente em mangues.
Por fim, temos a água doce, que possui salinidade inferior ou igual a 0,5%. Apesar do termo fazer alusão ao açúcar, na realidade, ele refere-se apenas a uma presença pequena de sal. É o tipo de água que usamos para beber e realizar nossas atividades diárias, como lavar roupas e tomar banho.A água doce pode ainda receber outras classificações, destacando-se a de água potável. Essa água não possui cor, cheiro e nenhuma substância ou organismo que pode trazer risco à saúde humana. É a água própria para consumo humano.
Existem ainda as águas chamadas de minerais, que, como o próprio nome indica, apresentam uma quantidade superior de sais minerais dissolvidos. Essas águas apresentam um sabor diferente das outras e possuem propriedades terapêuticas.
Geralmente elas são classificadas de acordo com sua composição química.Quando uma água, seja ela doce, salgada ou salobra, apresenta produtos que alteram as suas características físicas e químicas, dizemos que ela está poluída. Quando, além dessas alterações, ela apresenta organismos patogênicos ou substâncias tóxicas que provocam doenças no homem, dizemos que a água está contaminada.
Além das águas encontradas naturalmente, alguns tipos são produzidos em laboratório para que haja a pureza necessária para a realização de alguns estudos, produção de medicamentos e limpeza de alguns materiais, por exemplo. Esse é o caso da água destilada, que sofre o processo de destilação para a retirada de todas as substâncias e sais minerais nela presentes.
A água deionizada também é um tipo produzido em laboratório, entretanto, diferentemente da água destilada, ela não pode ser considerada pura. Ela caracteriza-se por não possuir apenas substâncias iônicas, não sendo livre de substâncias moleculares. Os processos para chegar à água deionizada são a troca iônica ou a osmose reversa.
Aula 3
Semana
Situação de Aprendizagem 8 – Como o ser humano utiliza a água? Podemos interferir nos modos como a sociedade vem utilizando a água?
CONTEÚDOS E TEMAS: Poluição ambiental; responsabilidades legais e pessoais; uso da água e sua preservação.
COMPETÊNCIA E HABILIDADES: Buscar dados e informações sobre poluição das águas; conhecer aspectos da legislação sobre a água e sobre seus usos, para compreender o problema e refletir sobre formas de atuação que auxiliam no enfretamento das situações cotidianas e na elaboração de propostas de intervenção em sua realidade.
A despoluição de um rio é possível?
Para realizar a despoluição de um rio, é fundamental que sejam instaladas estações de tratamento de esgoto e sejam feitas campanhas de conscientização.

É frequente a morte de animais aquáticos como consequência da poluição
Frequentemente ouvimos nos noticiários a respeito da falta de água em várias cidades brasileiras.
A pequena parcela de água doce disponível para consumo humano está sendo desperdiçada, poluída e contaminada, o que diminui, assim, nosso acesso a esse recurso.
A poluição e a contaminação das águas são problemas graves e ocorrem como consequência da falta de projetos que evitem o lançamento de esgoto e outros produtos poluentes nas águas de rios, lagos e mares.
Além disso, a falta de conscientização da população a respeito da importância da água doce faz com que substâncias e produtos sejam lançados inadequadamente nos rios.
A poluição e a contaminação fazem com que a água se torne imprópria para consumo, diminuindo, assim, a quantidade de água potável disponível para a população. Além disso, esses processos podem intensificar o surgimento de doenças e provocar grande incômodo em razão do mau cheiro gerado.
A despoluição de rios seria uma possível solução para contornar esse tipo de problema.Para despoluir um rio, é fundamental, primeiramente, a criação de estações de tratamento de esgoto, evitando assim que águas residuárias sejam lançadas de maneira inadequada nas águas.
Também é fundamental que a conscientização da população seja feita, pois muitos dos produtos encontrados, tais como sacolas e garrafas, são lançados pelos moradores de áreas próximas ou pessoas que acreditam que, por estar sujo, o material lançado por ele não fará diferença.
Entre os rios que passaram por tratamento ao redor do mundo, muitos já apresentam sinais de recuperação e há alguns que já estão completamente despoluídos. Dentre esses rios que receberam tratamento, o exemplo mais conhecido e mais surpreendente de despoluição é o do rio Tâmisa na Inglaterra.
A despoluição do rio Tâmisa durou mais de 100 anos e surpreendeu, pois o rio estava completamente sem vida. A estratégia de despoluição baseou-se principalmente na criação de estações de tratamento de esgoto, que anteriormente não existiam na região.
Hoje o rio encontra-se com diversas espécies de peixes, incluindo-se o salmão, que é um animal extremamente sensível às mudanças da qualidade de água.
Outro exemplo de rio despoluído é o Reno, que era conhecido como um dos mais poluídos de toda a Europa. Apesar de todo o processo durar um pouco mais de 20 anos, ele destaca-se pela ação conjunta de vários países para que o rio fosse salvo. Hoje, assim como o Tâmisa, o rio Reno apresenta grande quantidade de formas de vida aquática.
Aqui no Brasil a luta está em despoluir um dos rios mais famosos do país: o Tietê. Esse rio, que anteriormente era usado inclusive para a pesca, hoje se encontra em um nível avançado de contaminação e poluição. O projeto para despoluí-lo, que se iniciou em 1992, é audacioso e custará milhões de reais.Vale destacar que o sucesso da despoluição do Tietê e de outros rios só é possível graças aos esforços maciços dos governantes e da ajuda da população. Sendo assim, ao chegar em um local poluído, evite agravar o problema!
ÁGUA: A IMPORTÂNCIA DO USO CONSCIENTE E FORMAS DE ECONOMIZAR
Água: A importância do uso consciente e formas de economizar
Os reservatórios de água no país são instáveis, pois dependem da chuva e enchem e secam de maneira variável. As Nações Unidas estimam que em 2025, dois terços da população mundial vão sofrer com a escassez de água. É crucial entendermos a importância deste bem precioso, e o fato de que se torna cada vez mais importante economizar água.
- A importância de economizar água
O Brasil é um dos países com a maior quantidade de reservas hídricas que somam cerca de 15% do total de água disponível no planeta. Entre 2014 e 2016, passamos por algumas crises de água, como a do sistema da Cantareira, que fornece água para nove milhões de pessoas. Em 2016, o reservatório sofreu o maior colapso de sua história, atingindo boa parte da população paulista.
Segundo o mesmo estudo da ONU (Organização das Nações Unidas) uma pessoa precisa de 110L de água para atender todas as suas demandas diárias, no Brasil, a média da população gasta 200L de água por dia.
Lembrando que vivemos em um país onde muitos não tem acesso à água potável diariamente, o que torna nossa média ainda mais preocupante.Poupar água é muito necessário, não apenas quando sua cidade ou seu condômino está em racionamento, e é por isso que nossas dicas podem te ajudar.
- Dicas para economizar água
- Uma das maneiras mais interessantes de poupar água é reutilizá-la!Os resultados gerados são enormes. Reaproveite a água da chuva, banho, máquina de lavar e também a do ar-condicionado, para limpar a calçada, automóveis e usar na descarga de vasos. Para não atrair o mosquito da dengue utilize recipientes com tampas.
- Evite lavar roupa muitas vezes durante a semana, procure acumular quado possível, lavando o máximo de cada vez. O consumo por ciclo de lavagem é em torno de 100L a 132L.
- Parece loucura, mas é possível lavar o carro usando menos de um litro de água, para isso precisamos de panos de microfibra, um pulverizador e shampoo para lavagem de carris. Dilua o produto na água e aplique com o pulverizador na lataria do carro, passe o pano de microfibra para que a sujeira seja absorvida, depois use outro pano que esteja seco para dar brilho.
- Os pulverizadores ou borrifadores são ótimos na limpeza, pois direcionam a água no local exato a ser higienizado, diminuindo a quantidade a ser usada e rendendo muito mais.
- O gasto usando mangueiras na limpeza é muito grande. O ideal é utilizar baldes, pois esses armazenam melhor a água, otimizando a limpeza e reduzindo o desperdício. Existem algumas linhas com duas águas, que separam a água limpa da suja, além de alguns possuírem o sistema quebra ondas, que ao deslocar o balde reduz o derramamento de água e evita acidentes. Combinando com o pano úmido pode se fazer uma limpeza muito mais prática, eficiente e utilizando somente a quantidade de líquido necessário, não precisando trocar pano nem fazer esforço.
- Para economizar no banho, desligue o chuveiro ao se ensaboar e diminua o tempo embaixo da ducha. O banho ideal é de 5 minutos, o que equivale a 30 litros de água.
- E não menos importante, não esqueça de economizar na torneira.Não deixe a água correndo enquanto estiver realizando as suas atividades rotineiras, sejam elas: lavar alimentos, escovar os dentes, fazer a barba, tomar banho, lavar louça, etc. É importante que você não esqueça de fechar bem as torneiras, para evitar que elas fiquem gotejando.
- Adote descarga de caixa acoplada no vaso sanitário. É importante que você saiba da importância de ter um vaso sanitário que não consuma uma quantidade exacerbada de água. O vaso sanitário com a válvula e tempo de acionamento de 6 segundos gasta cerca de 15 litros. Quando a válvula está defeituosa, pode chegar a gastar mais que o dobro.
- Para detectar vazamentos, busque periodicamente fechar o registro. É importante que você verifique se o relógio continua a contar, isso mostra se suas instalações estão com vazamentos ou não.
É possível viver com a quantidade de água estabelecida pela ONU?
Segundo a ONU (Organização das Nações Unidas), a quantidade de água suficiente para atender as necessidades básicas de um indivíduo é de 110 litros.
No ano de 2013, o consumo médio por pessoa calculado no Brasil era de 166,3 litros por dia, no Rio de Janeiro e Maranhão, por exemplo, esse índice excedia os 200 litros.
Com a crise que se instalou nos últimos meses, a dúvida começou a ser mais discutida: é realmente possível viver com 110 litros de água por dia?
Listaremos agora algumas atividades básicas e o quanto de água é gasto para a realização de cada uma, baseando-se em uma pessoa que mora em casa (os cálculos não são exatamente os mesmos para apartamentos)
Banho
– 12 litros de água Um banho com duração de dois minutos consome aproximadamente 12 litros de água. O ideal é que o chuveiro seja ligado somente para o primeiro enxague do corpo, e depois para retirar o sabonete. Durante o tempo de se ensaboar, utilizar xampu e outras atividades, o chuveiro deve permanecer desligado.
Beber água
– 2 litros O consumo diário recomendado é de 2 litros, mas esse índice varia de pessoa para pessoa.
Descarga
– 12 litros Duas descargas por dia consomem aproximadamente 12 litros no caso de vasos sanitários com caixa acoplada. A dica para economizar é utilizar um balde para que a descarga não seja acionada mais vezes.
Escovar os dentes
– 2,7 litros A torneira deve ser mantida desligada durante todo o tempo da escovação, e deve ser ligada somente para umedecer a escova antes de colocar o creme dental e depois, para limpeza da mesma. O cálculo de consumo é medido levando em conta 5 segundos com a torneira ligada, 3 vezes por dia.
Uma ideia boa é manter um copo com água do lado da pia, assim você pode utilizá-la para enxaguar a boca e reservá-la para alguma outra atividade.
Lavar a louça
– 55,2 litros A torneira da pia ligada por 4 minutos consome 55,2 litros, por isso, na hora de ensaboar a louça, ela deve ser desligada.
Outra prática que ajuda a economizar é remover bem o excesso de resíduos dos pratos e copos, assim a lavagem de louça propriamente dita durará menos tempo.
Lavar roupa na máquina
– 19 litros O recomendado é juntar toda a roupa da semana e lavar de uma única vez. O gasto médio é de 135 litros, divididos nos 7 dias, o gasto diário é de 19 litros.
O total é de 102,9 litros, ou seja, é possível sobreviver com a quantidade de água estabelecida pela ONU, e a água acumulada em todas as atividades pode ser utilizada para limpar o chão de casa e fazer faxina nos móveis se necessário
.Fonte: UOL
Aula 3
Semana Situação de Aprendizagem 2 – Dissolução de materiais em água e mudança de suas propriedades.Conteúdos e temas: Calor específico; densidade; temperatura de ebulição da água com a presença de solutos; solubilidade; outras propriedades.Competência e habilidades. Reconstruir o conceito de solubilidade em um nível mais amplo, como “extensão da dissolução”; compreender como as propriedades peculiares da água possibilitam a existência de vida no planeta; a partir de dados experimentais, concluir como a presença de solutos afeta as propriedades características da água; aplicar esses conhecimentos na resolução de problemas ambientais, industriais e relacionados com a saúde.
A água nossa de cada dia A água nos parece ser simples demais. Nada mais falso! Com mais de 70 comportamentos fora de série, é um material com inúmeras aplicações.
A água é um líquido estranho. Quando olhamos um copo de água gelada, não percebemos os grandes mistérios que este material guarda. Em um mundo altamente tecnológico, ficamos maravilhados com o silício, que possui a propriedade extraordinária de aumentar a sua condutividade ao ser dopado por pequenas quantidades de outro material. Esta propriedade interessante possibilitou a criação dos chips de computador mais de cem anos depois de ter sido observada pela primeira vez.
Por outro lado, a água nos parece ser simples demais. Nada mais falso!Notem: o silício tem somente uma propriedade diferente do que a maioria dos materiais apresenta, por ser um semicondutor, e já é um sucesso; a água tem mais de 70 comportamentos fora de série, e é, portanto, um material com inúmeras aplicações. Ilustremos um destes comportamentos.
Se você pegar um cubo de gelo e colocar na água líquida, ele flutua, porque gelo é menos denso do que água. Isto é anormal, pois a fase sólida dos demais materiais é mais densa que sua fase líquida. Uma barra de metal, por exemplo, afunda no metal líquido. Ainda mais espetacular do que gelo flutuar em água, é água a 0º C flutuar em água a 4º C. Assim, no inverno, em locais que alcançam temperaturas negativas, os rios e lagos congelam somente na superfície, permitindo que peixes e plantas sobrevivam no fundo, que está a uma temperatura de 4º C. Isto, inclusive, permitiu que algumas plantas, insetos e pequenos animais tenham sobrevivido a uma das últimas eras glaciais, quando a Terra ficou coberta de gelo.
Outra propriedade fundamental para a vida é o calor específico, Cp, que é quanto calor tem que ser dado para um material aumentar em 1º C a sua temperatura. No caso da água, o Cp tem um valor alto, o que significa que é necessário dar muito calor para a água aumentar em 1º C a sua temperatura. Observamos isso quando vamos a uma piscina para nadar. A água durante um dia quente estará mais fria do que o concreto do piso que contorna a piscina, pois, para aumentar a temperatura da água em 1º C, é necessário fornecer mais calor do que para aumentar a temperatura do concreto. Esta propriedade extraordinária permite que os oceanos não tenham uma variabilidade de temperatura muito elevada, o que igualmente ajuda na manutenção da vida. Mas há coisas bem quotidianas nas quais podemos usar esta propriedade. Se queremos esfriar uma panela de pressão bem quente rapidamente, a colocamos em contato com a água, ao invés de a deixarmos em contato com o ar, pois a capacidade de absorver calor da água é maior do que a do ar. A indústria usa esta anomalia da água – absorver mais calor do que outros materiais – para controle de temperatura.
Além disso, água é um solvente fantástico. Água dissolve bem o sal do nosso sangue e da nossa comida, e o açúcar do nosso café. A água, no entanto, tem seus desafetos. Água detesta compostos apolares (moléculas que, diferentemente da água, são mais democráticas na sua distribuição de elétrons, e não têm acúmulo de cargas em uma dada direção), particularmente óleos.
Para resolver este conflito entre água e óleo, é possível usar moléculas surfactantes, como o detergente de cozinha, que une estes dois grandes inimigos. Este jogo de amor e ódio que certos materiais têm com a água tem sua utilidade. Cobrimos o sofá da sala com um polímero que odeia água para que o mesmo não molhe e usamos materiais que amam água para absorver água do ar como, por exemplo, o sal de cozinha – se o deixamos exposto em um dia úmido, ele transforma o vapor de água em água.
Isto ocorre porque o sal é polar (tem uma distribuição de carga). Em regiões áridas, se usam polímeros com grupos com cargas para fabricar redes que capturam água do ar .Mas o que faz com que a água seja assim tão especial? A molécula de H2O em seu formato simples guarda um segredo.
O oxigênio, com seus oito elétrons, para se equilibrar eletronicamente precisa de mais dois elétrons, enquanto cada hidrogênio, com somente um elétron, precisa de um elétron a mais para se equilibrar. Para resolver este problema, a natureza criou uma solução socialista, através da negociação perfeita chamada de ligação covalente. O oxigênio empresta um elétron para cada hidrogênio e cada hidrogênio empresta o seu único elétron para o oxigênio.
Em média, cada hidrogênio fica com dois elétrons e cada oxigênio com dez elétrons.
A ligação covalente, no entanto, não é igualitária. O oxigênio por ter mais prótons, puxa todos os elétrons para a sua vizinhança. Os hidrogênios ficam com os elétrons, mas estes não ficam próximos ao H e sim ao O, ficando a molécula polarizada. Surge assim a “ligação de hidrogênio”.
Enquanto a ligação covalente é entre átomos, a de hidrogênio é entre moléculas, sendo esta última bem mais fraca do que a primeira. Se a ligação covalente é um casamento entre o oxigênio e o hidrogênio, a ligação de hidrogênio é um flerte fortuito entre o hidrogênio de uma molécula e o oxigênio da molécula vizinha. Devido ao formato em V das ligações covalentes, como ilustra a figura 1.
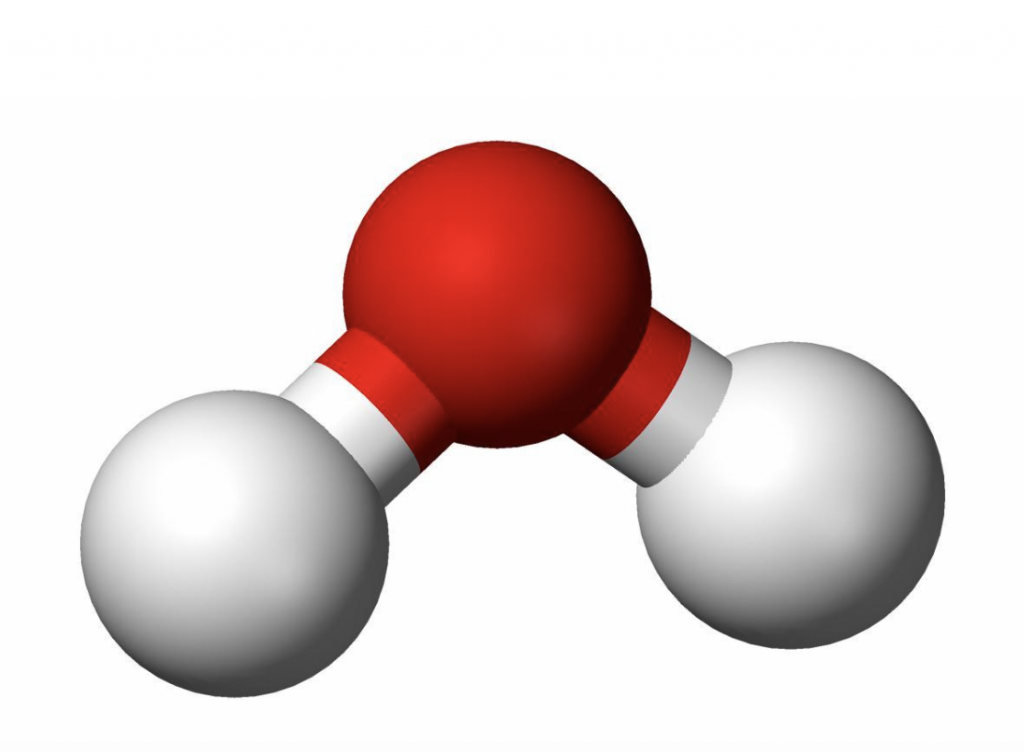
Figura 1 – O oxigênio é representado pela esfera vermelha, e os hidrogênios pelas brancas. (Imagem: Creative Commons)
cada molécula de água pode formar até quatro ligações de hidrogênio. Imagine você estar no centro de um cubo, com os dois braços apontando para dois vértices em diagonais opostas da face superior do cubo e os dois pés apontando para dois vértices em diagonais opostas na face inferior do cubo, alternadas em relação às superiores, como ilustra a figura 2.
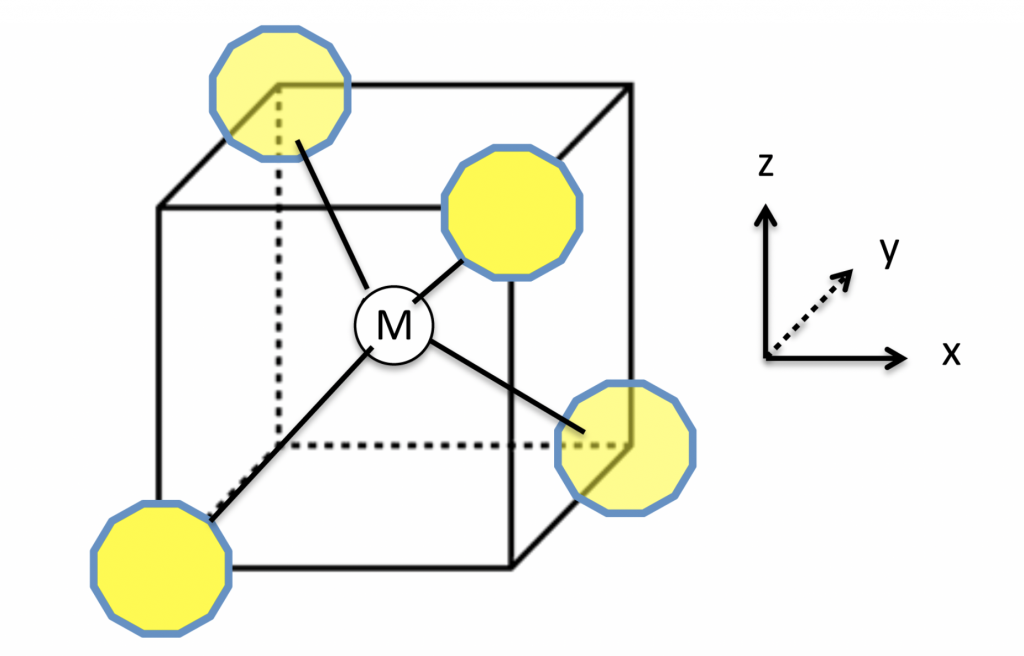
Figura 2 – M representa uma molécula central de água que se liga com outras quatro (em amarelo) através de ligações de hidrogênio com direções e distâncias específicas. (Imagem: Creative Commons)
As quatro ligações de hidrogênio são exatamente assim. Note que elas têm uma distância e ângulo bem precisos. Assim, a baixas temperaturas, o gelo forma todas as ligações possíveis, mas ao aumentar a temperatura algumas ligações são rompidas, o que permite que as moléculas se aproximem, aumentando a densidade e, por isso, o gelo é menos denso que a água a 4º C.
A presença das ligações também explica o calor específico elevado, pois é necessário dar calor para romper a ligação e, somente depois de rompida, aumentar a temperatura. Materiais que têm cargas livres, como o sal de cozinha, ou que formam ligações de hidrogênio com a água, como os álcoois, amam a água e se dissolvem bem na água; materiais sem cargas, como os polímeros que usamos para cobrir o sofá da nossa casa, odeiam água e não se solubilizam em água e, por isso, são ótimos para impedir que algo se molhe.Além de propriedades termodinâmicas, a água se move de maneira peculiar.
Na grande maioria dos materiais, a mobilidade das moléculas aumenta com a diminuição da densidade do sistema, pois o espaço para se mover aumenta. Se queremos fazer o óleo fluir mais, aumentamos a temperatura para diminuir a densidade.
Na água, no entanto, a baixas temperaturas a mobilidade aumenta com o aumento da densidade.
As moléculas de água a altas densidades têm ligações de hidrogênio muito promíscuas que se formam e se desfazem rapidamente, permitindo à água se mover de uma molécula vizinha à outra. A água se comporta como um bando de foliões no carnaval, onde a densidade de pessoas é enorme: as pessoas se movem rapidamente, largando o braço de um companheiro de bloco e passando ao braço de outro.
Uma consequência interessante desta alta mobilidade é que se colocarmos a água confinada em tubos muito fininhos (10.000 vezes mais finos do que um fio de cabelo), a água flui através do tubo a uma velocidade que pode ser até 1.000 vezes maior do que se espera para a maioria dos materiais. O que ocorre é que a água confinada em volumes pequenos se move usando a rede de ligações de hidrogênio.
Para um tubo bem fininho, as moléculas formam uma linha compacta, que se move como se fosse um tubo dentro de outro tubo como mostra a figura 3. Este fenômeno tem uma aplicação muito importante.
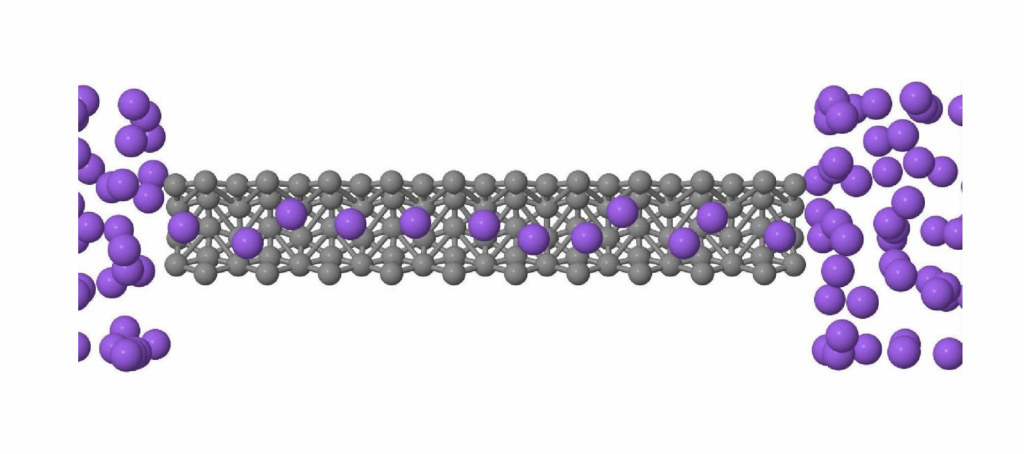
Figura 3 – Nanotubo em cinza e água em roxo. As moléculas fazem uma fila no superfluxo. (Imagem da autora)
Qual a utilidade deste superfluxo?
Hoje uma em cada seis pessoas no mundo vive em regiões onde há stress hídrico, ou seja, vivem em regiões que não têm água suficiente para produzir a sua subsistência, e este número em 2030 irá chegar a 50% da população. No Brasil, temos regiões que não têm água suficiente para a sobrevivência, e o crescimento não planejado da agricultura adicionado ao uso indiscriminado de agrotóxicos tem levado a situações de falta de água em regiões como São Paulo.
Este quadro, com o crescimento da população, mudança do clima e contaminação da água potável, irá se agravar mundialmente nos próximos anos.Uma solução que se usa para isso é a dessalinização de água do mar ou salobra. Hoje na Califórnia, em algumas ilhas do Caribe, em diversos países do Oriente Médio e na ilha de Fernando de Noronha, a dessalinização é uma realidade.
Uma alternativa é o processo de osmose reversa, usado na Califórnia, que consiste em empurrar a água através de um filtro que permite a passagem de água, mas não a de sal. Este processo é caro e ineficiente, pois as plantas de dessalinização são instalações enormes e se justificam somente para abastecer grandes cidades, pois o processo não tem um equivalente em pequena escala.
O defeito deste processo é que não usa nenhuma das propriedades mágicas da água.Com a descoberta recente do superfluxo da água confinada, alguns pesquisadores têm proposto o uso de nano estruturas para separar a água do sal. A água atravessa os nanotubos de carbono com um superfluxo e o sal, devido à barreira dielétrica da membrana nanométrica, fica fora da membrana.
Para que o processo ocorra, os poros devem ter 2 nanômetros de diâmetro, o que por si só é um desafio para a produção em série. A boa nova é que testes laboratoriais realizados na Universidade da Califórnia e testes computacionais realizados por diversos grupos, inclusive o do Instituto de Física da Universidade Federal do Rio Grande do Sul que coordeno, mostraram que este processo seria em ordens de grandeza mais eficiente do que aquele usado atualmente, tornando as plantas de dessalinização mais eficientes, exigindo um consumo menor de energia e filtros menores, ou seja, factíveis para pequenas cidades ou mesmo para bairros. Esperamos que com o desenvolvimento de tecnologias de larga escala para a produção de nanotubos, grafeno ou do MoS2 em quantidade suficiente para construir membranas como a ilustrada na figura 4, em dez anos esta tecnologia esteja implementada no mundo ou, quem sabe se voltarmos a ter um financiamento regular e ininterrupto em ciência e tecnologia, mesmo no Brasil.
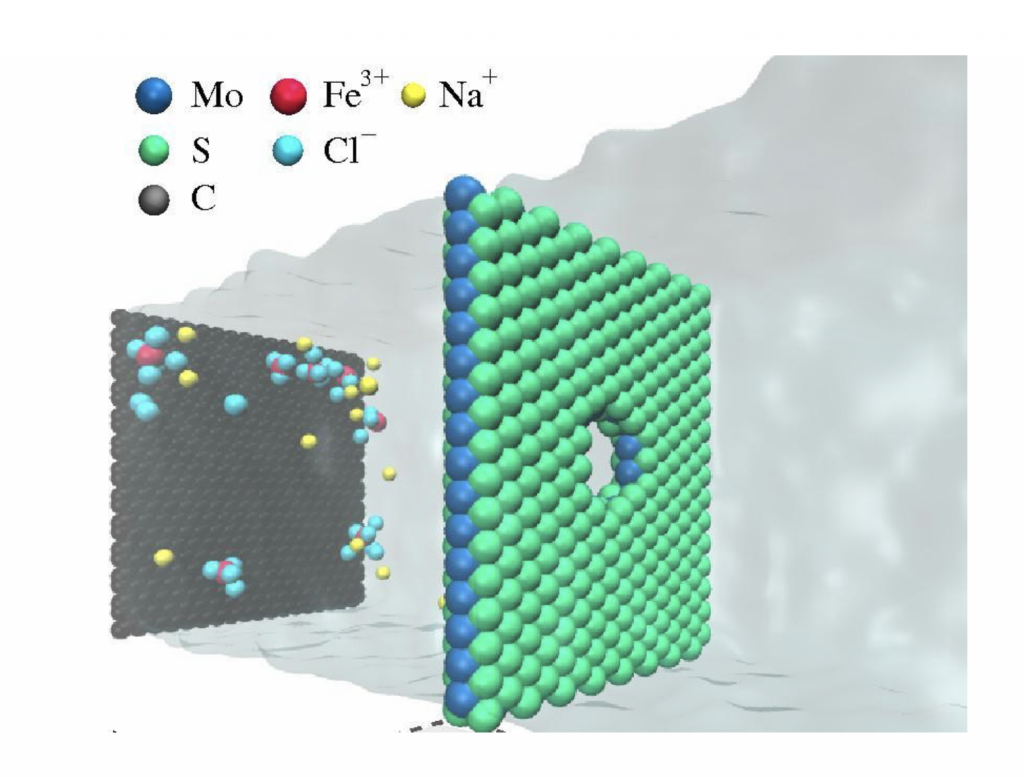 Figura 4 – Sal e água (região sombreada) passando através de uma membrana nanométrica de Dissulfeto de Molibdênio. (Imagem da autora)
Figura 4 – Sal e água (região sombreada) passando através de uma membrana nanométrica de Dissulfeto de Molibdênio. (Imagem da autora)Aula 4
12ª semana
23/04 a 27/04/2018Situação de Aprendizagem 6 – Tratamento da Água – Uma questão de sobrevivência
CONTEÚDOS E TEMAS: Etapas de Tratamento da água.
COMPETÊNCIA E HABILIDADES.Compreender a necessidade de tornar a água potável; conhecer procedimentos para seu tratamento, aplicando conceitos e processos como separação de sistema heterogêneos, solubilidade e transformação química; organizar e interpretar informações sobre o tratamento e consumo de água para refletir sobre o uso consciente da água e tomar suas decisões dentro dos limites, a esse respeito.
Aula 5
SOLUÇÕES
CONCENTRAÇÕES DAS SOLUÇÕES
O que são concentrações de soluções químicas?Concentrações de soluções químicas é a relação entre quantidade de soluto e quantidade de solvente ou de solução. A ideia é bem intuitiva. Um local onde tem muita gente concentrada indica que tem muita gente em um determinado espaço. Perceba que há uma relação de quantidade entre pessoas e espaço.O mesmo acontece com soluções!No caso de soluções essas quantidades podem ser expressas em mol, massa ou volume. E aí podem ser feitas as diversas combinações entre mol, massa e volume para obter uma relação de concentração.
DEFINIÇÕES
Uma solução é uma mistura homogênea (tipo de mistura onde não é possível distinguir de forma individual cada um dos seus componentes) de um soluto (substância sendo dissolvida) em um solvente (substância que efetua a dissolução).As soluções são encontradas em quaisquer dos três estados físicos: gasoso, líquido ou sólido.
O ar, solução gasosa mais comum, é uma mistura de nitrogênio, oxigênio e quantidades menores de outros gases. Muitas ligas metálicas são soluções sólidas como o “níquel” das moedas (25% Ni, 75% Cu).
As soluções mais familiares estão no estado líquido, especialmente aquelas nas quais a água é o solvente.Quanto a proporção soluto/solvente, as soluções podem ser diluídas, concentradas, insaturadas, saturadas ou supersaturadas.
Podemos descrever uma solução contendo uma pequena quantidade de soluto como diluída e outra, contendo mais soluto na mesma quantidade de solvente como concentrada.
A solução saturada onde a quantidade de soluto é igual ao coeficiente de solubilidade(quantidade limite de soluto que pode ser adicionado a um determinado volume de solvente),as soluções insaturadas são as que possuem quantidade de soluto menor que o seu coeficiente de solubilidade e as super – saturadas apresentam a quantidade de soluto maior que o seu coeficiente de solubilidade, sendo estas muito instáveis e de difícil preparo.
Quanto à condutividade elétrica, as soluções podem ser eletrolíticas ou iônicas. As partículas dissolvidas são íons, bons condutores de eletricidade. É o caso das soluções aquosas de ácidos, bases e sais.
E não–eletrolíticas ou moleculares onde as partículas dissolvidas são moléculas não conduzindo eletricidade. É o caso da sacarose em água.
DILUIÇÃO DE SOLUÇÕES
Fazemos uma diluição quando adicionamos mais solvente a uma solução já existente, de modo que a concentração da solução diminua.
No cotidiano é muito comum realizarmos diluições. Por exemplo, geralmente os rótulos de sucos concentrados indicam que o preparado desses sucos deve ser feito acrescentando-se água numa proporção determinada. Quando fazemos isso, estamos diluindo o suco.
Atenção: Não confunda diluição com dissolução. Quando estamos fazendo um suco e adicionamos o soluto (refresco em pó, por exemplo) ao solvente (água), está ocorrendo uma dissolução. Mas quando acrescentamos mais água a uma solução de água com refresco em pó, temos uma diluição.
Essa prática também é muito comum nos laboratórios, pois geralmente as soluções que são comercializadas vêm numa concentração bem alta e, de acordo com a finalidade, os cientistas preparam soluções mais diluídas a partir da solução inicial.Essas soluções costumam ser preparadas pegando-se uma alíquota, isto é, uma parte da solução inicial com uma pipeta, que é um instrumento utilizado para medir e transferir volumes de líquidos com alta precisão.
Essa alíquota é transferida para um balão volumétrico e, por último, acrescenta-se a água até atingir o volume desejado e indicado pelo balão volumétrico.Mas surge uma pergunta:
Como saber o volume da alíquota que se deve pegar para preparar a solução?
Bem, isso depende de qual concentração queremos que a solução tenha. Quando realizamos uma diluição, a massa do soluto permanece inalterada, como mostra a imagem abaixo:No entanto, a massa do solvente mudou e, consequentemente, a massa e a concentração da solução também mudaram.
Tendo em vista que a fórmula da concentração comum é dada pela divisão entre a massa do soluto pelo volume da solução, temos o seguinte:
Cinicial = __m1__ Cfinal = __m1__
Vinicial Vfinal
m1 = Cinicial . Vinicial m1 = Cfinal . Vfinal Cinicial . Vinicial = Cfinal . Vfinal
Por meio dessa relação é possível determinar a concentração da solução final. Veja um exemplo abaixo:“500 mL de água foram adicionados a uma solução aquosa de ácido sulfúrico (H2SO4(aq)) de volume inicial igual a 200 mL e concentração de 20 g/L. Qual a concentração da solução após essa diluição?”
Resolução:Dados:Se a concentração inicial era de 20 g/L, isso significa que em cada litro da solução há 20 gramas de soluto (ácido sulfúrico) dissolvido. Assim, basta fazer uma regra de três para descobrir qual a massa do soluto que está dissolvida em 200 mL (0,2 mL) da solução:20 g de ácido sulfúrico ——— 1 L de solução
m1 ——— 0,2 L
1 . m1 = 0,2 . 20
m1 = 4 g
Agora, para descobrir a concentração final basta usar a expressão abaixo:
Cinicial . Vinicial = Cfinal . Vfinal
(20 g/L) . 0,2 L = Cfinal . (0,2 L + 0,5 L)
Cfinal = _4g_
0,7L
Cfinal = 5,7 g/L
A mesma relação pode ser feita com a concentração em mol/L, com o título em massa e com a fração molecular, como mostra a tabela abaixo:
Aula 6
4ª semana 26/02/2018 a 02/03/2018
Situação de Aprendizagem 3 – Concentração de Soluções – – unidades de concentração; % em massa g.L-1; ppm.Compreender o conceito de concentração; compreender as unidades que expressam a composição das soluções e utiliza-las adequadamente; realizar cálculos envolvendo as diferentes unidades de concentração e aplica-los no reconhecimento de problemas relacionados a quantidade da água para o consumo.
CONCENTRAÇÃO DE SOLUÇÕES
Concentração é o termo que utilizamos para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução. As quantidades podem ser dadas em massa, volume, mol, etc. A concentração de uma solução deve ser expressa em unidades quantitativas. São usadas as chamadas unidades de concentração que são medidas quantitativas da afinidade de soluto que se dissolve. A quantidade relativa de uma substância é conhecida como concentração e é expressa em diferentes unidades.
TIPOS DE CONCENTRAÇÃO1.Concentração Comum (C)
Também chamada concentração em g/L (grama por litro), relaciona a massa do soluto em gramas com o volume da solução em litros.Onde:
C = concentração comum (g/L)
m1= massa do soluto(g)
V = volume da solução (L)Exemplo:
Qual a concentração comum em g/L de uma solução de 3L com 60g de NaCl?
OBS: Concentração comum é diferente de densidade, apesar da fórmula ser parecida. Veja a diferença:A densidade é sempre da solução, m2 então:
Na concentração comum, calcula-se apenas a m soluto, ou seja, m1Cada grandeza tem um índice. Utilizamos índice:
1 = para quantidades relativas ao soluto
2 = para quantidades relativas ao solvente
nenhum índice = para quantidades relativas à soluçãom=m1+m2
2. Densidade
Densidade é a massa por unidade de volume de uma substância. O cálculo da densidade é feito pela divisão da massa do objeto por seu volume.(UFU-MG) Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm3. A massa desse metal, da qual um garimpeiro de Poconé (MT) necessita para encher completamente um frasco de meio litro de capacidade, é de?”
Resolução:
Dados:
dmercúrio = 13 g/cm3
V = 0,5 L = 500 mL = 500 cm3
m = ?
Da fórmula da densidade, temos:
d = m/V
m = d . V
m = (13 g/cm3) . (500 cm3)
m = 6500 g
Por exemplo, digamos que você quer descobrir a densidade de um pedaço de ferro de forma irregular. Depois de determinar a massa desse objeto, você determinará o volume dele fazendo o seguinte:
- Coloque determinado volume de água em uma proveta;
- Depois pegue o pedaço de ferro e coloque-o totalmente submerso nessa proveta;
- Observe qual foi a diferença no volume da água. Pronto! Esse é o volume do sólido!
Por exemplo, digamos que a massa “pesada” deu igual a 39,5 g e que o volume de água na proveta aumentou de 50 mL para 55 mL, então a diferença do volume, isto é, 5 mL, corresponde ao volume do pedaço de ferro. Calculando a densidade dele, temos:d = m
Vd = 39,5 g
5 mL
d = 7,9 g/mL
Essa é exatamente a densidade do ferro a 20ºC.Pode-se dizer também que quanto menos o volume de água for deslocado, menos denso é o objeto.
3. Título ou Porcentagem em massa de uma solução
É a relação (razão) entre a massa do soluto e a massa da solução. Ele não tem unidades e pode ser expresso também em porcentagem. Nesse caso é só multiplicar o resultado por 100%. Além disso, existe a porcentagem em volume da solução

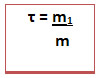
A massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente (m = m1 + m2).
O título é adimensional, isto é, um número puro e sem unidades. No entanto, se você quiser expressar essa relação dizemos que determinada solução possui título igual a 0,35, isso significa que para cada unidade de massa da solução há 0,35 unidade de massa de soluto e 0,65 unidade de massa de solvente.Um exemplo bastante comum do uso da porcentagem no cotidiano ocorre em soluções aquosas, como é o caso do soro fisiológico.
O soro fisiológico é uma solução de NaCl (cloreto de sódio – sal de cozinha), que apresenta uma porcentagem em massa de 0,9 %. Isso significa que existem 0,9 grama de NaCl para cada 100 gramas de solução. Assim, podemos concluir que seu título é 0,009 em porcentagem em massa (τ%), basta multiplicar o resultado por 100%. Assim, quando

O exemplo é uma solução líquida, mas o título é usado para exprimir a concentração em qualquer estado de agregação (sólido, líquido ou gasoso).No caso de soluções em que todos os componentes são gasosos ou são líquidos é possível também calcular o título em volume (τv), por relacionar o volume do soluto com o volume da solução (v),
.
segundo a fórmula:
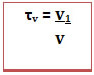
O título em volume também pode ser expresso em porcentagem:
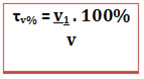
A diferença que existe quando se trabalha com o título em volume é que no título em massa, conforme dito anteriormente, a massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente. Já aqui isso não é possível, isto é, não podemos somar o volume do soluto com o volume do solvente para obter o volume da solução. Isso ocorre porque as forças intermoleculares existentes entre esses líquidos alteram os seus volumes quando se misturam. Portanto, o volume da solução deve ser medido experimentalmente ou fornecido no exercício.Por exemplo, a seguir temos a imagem de um frasco de álcool etílico que indica a porcentagem em volume de 96%. Isso quer dizer que em cada 100 unidades de volume da solução, 96 unidades são do álcool e apenas 4 sãode água.
.jpg)
4. Partes por Milhão (ppm)
Concentração PPM Partes por milhão ou abreviadamente ppm é a medida de concentração que se utiliza quando as soluções são muito diluídas. Concentrações ainda menores podem ser expressas em partes por bilhão (ppb), partes por trilhão, etc, no que se chama partes por notação, da qual a ppm é a mais usual.

A concentração em ppm é muito usada para medir gases poluentes no ar e metais pesados na água
Quando a concentração de uma solução (principalmente líquidas e gasosas) é dada em valores extremamente pequenos, costuma-se utilizar a unidade parte por milhão (ppm).A concentração de soluções químicas refere-se à quantidade de soluto que existe em uma quantidade padrão de solução ou em uma quantidade padrão de solvente. Assim, a concentração em partes por milhão pode ser definida da seguinte maneira:
* Partes por milhão (ppm): Indica quantas partes de soluto (em massa ou em volume) existem em um milhão (1 000 000 ou 106) de partes da solução (também em massa ou em volume).
Isso significa que podemos descobrir o ppm pela seguinte expressão matemática:
x ppm = __x parte do soluto__
106 partes de solvente (solução)
Visto que a quantidade de soluto é extremamente pequena, nos cálculos que utilizam a fórmula acima, o volume ou a massa da solução serão considerados exatamente os mesmos do solvente, ou seja, se soubermos que uma solução aquosa de permanganato de potássio (KmnO4(aq)) tem concentração de 70 ppm, isso significa que existem 70 g de permanganato em 1 milhão de gramas da solução ou de água, conforme mostra a fórmula:
70 ppm = _70 g do permanganato_
106 g de água
Tendo em vista que:106 g = 1 t;
10-3 g = 1 mg;
103 g = 1 kg;
10-6 g = 1 μg.
Podemos fazer então o cálculo usando também as seguintes relações:
* 1 ppm = 1 g do soluto__
1 t de solvente (solução)* 1 ppm = 1 mg do soluto__
1 kg de solvente (solução)* 1 ppm = 1 μg do soluto__
1 g de solvente (solução)
Relações similares podem ser feitas com as unidades de volume:*
1 ppm = 1 L do soluto__
1000 m3 de solvente (solução)* 1 ppm = 1 mL do soluto__
1 m3 de solvente (solução)* 1 ppm = 1 μL do soluto__
1 L de solvente (solução)* 1 ppm = 1 mL do soluto__
1000 L de solvente (solução)
Também podemos relacionar massa e volume em soluções, por exemplo, que são formadas por um soluto sólido dissolvido em um solvente líquido:
* 1 ppm = 1 g do soluto__
1000 L de solvente (solução)* 1 ppm = 1 mg do soluto__
* 1 ppm = 1 μL do soluto__
1 mL de solvente (solução)
Assim como ppm significa “partes por milhão”, ppb significa “partes por bilhão”, e ppt é “partes por trilhão”:
x ppb = __x parte do soluto__
109 partes de solvente (solução)x ppt = __x parte do soluto__
1012 partes de solvente (solução)
Essas concentrações tão pequenas são aplicadas principalmente quando se trabalha com dados referentes à poluição do ar e da água. Veja abaixo uma tabela que mostra os principais gases-estufa presentes na atmosfera terrestre e a sua abundância (dados de 1998):
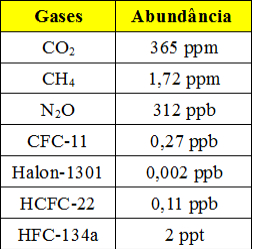
Tabela com abundância de gases-estufa na atmosfera
Esse é um exemplo que mostra que o uso desse tipo de concentração é importante tanto para estabelecer um limite máximo para esse e outros poluentes quanto para monitorá-los. Também pode ser usado em cosméticos e produtos de limpeza e higiene pessoal para mostrar a quantidade de seus constituintes.Veja agora dois exemplos de exercícios envolvendo o cálculo da concentração de soluções em ppm e ppb:
Exemplo 1: (Fatec-SP) No rótulo de uma garrafa de água mineral lê-se, entre outras informações:Conteúdo: 1,5 litro;
Nitrato de sódio: 6,0 ppm.Considere que 1 ppm equivale a 1 mg de soluto por litro de solução aquosa. A massa de nitrato de sódio ingerida por uma pessoa que bebe um copo 300 mL dessa água é?
a) 0,003 g
b) 0,0018 g
c) 9,0 g
d) 6,0 mg e) 1,2 mg
Resolução:
1 mg de nitrato de sódio (1 ppm) ——- 1 L6 mg de nitrato de sódio (6 ppm) ——- 1000 mLx————————– 300 mLx = 300 . 6
1000
x = 1,8 mg de nitrato de sódio
1 g —– 1000 mg
y——– 1,8 mg
y = 1,8 . 1
1000
y = 0,0018 g de nitrato de sódioA alternativa correta é a letra “b”.
Exemplo 2: (Fatec-SP) Uma das formas de medir o grau de intoxicação por mercúrio em seres humanos é a determinação de sua presença nos cabelos. A Organização Mundial de Saúde (OMS) estabeleceu que o nível máximo permissível, sem risco para a saúde, é de 50 ppm, ou seja, 50. 10-6 g de mercúrio por grama de cabelo. Forneça a expressão dessa concentração em ppb.
Resolução:
1 bilhão = 109.50 partes de mercúrio —- 106 partes de cabelox——————————109 partes de cabelox = 109 . 50
106
x = 5 . 104 ppb
Aula 6
Semanas
Situação de Aprendizagem 4 – Utilizando a grandeza quantidade de matéria (mol); concentração em mol . L-1. Fazer usos da linguagem química; construir o conceito de concentração em quantidade de matéria/volume para ampliar a compreensão do significado da concentração e aplica-lo a novas situações que permitem melhor entendimento do mundo físico.
CONTEÚDOS E TEMAS: Relações quantitativas de massa e de quantidade de matéria (mol) nas transformações químicas que ocorrem em soluções.
COMPETÊNCIA E HABILIDADES.Construir e aplicar conceitos relativos ás proporções de reagentes e produtos numa reação em solução, compreendendo a importância desses cálculos na sociedade; interpretar a equações químicas em termos quantitativos.
5. Concentração em mol/L Molaridade (M)
A molaridade de uma solução é a concentração em número de mols de soluto e o volumede 1L de solução.Onde:
M = molaridade (mol/L)
n1= número de mols do soluto (mol)
V = volume da solução (L)Concentração é o termo que utilizamos para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução.
As quantidades podem ser dadas em massa, volume, mol, etc.
Observe:
m1= 2g
n2 = 0,5mol
V = 14L
Exemplos:
massa de 2g do soluto NaCl: m1= 2g
número de mols de 0,5mol do solvente água: n2 = 0,5mol
volume da solução de 14L:
V = 14L
Em laboratório, é muito importante conhecer a concentração em mol/L das soluções químicas
A concentração em mol/L (M) é também muito conhecida como Concentração Molar, e também Molaridade. No entanto, esses nomes, apesar de bastante difundidos, não são recomendados pela SBQ (Sociedade Brasileira de Química).
Os nomes corretos são Concentração em mol/L ou Concentração em quantidade de matéria.Em laboratórios e indústrias químicas, essa é a concentração mais utilizada, pois é a recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional da Química Pura e Aplicada (IUPAC).
É uma relação mais sofisticada que a concentração comum.Seu cálculo é feito dividindo-se a quantidade de matéria ou substância (mol) pelo volume da solução, conforme a expressão matemática abaixo:
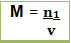
Onde M = concentração em mol/L
n1 = número de mols do soluto (mol), lembrando que o índice 1 indica grandezas relacionadas ao soluto
v = volume da solução (L)Desse modo, se for dito que uma solução tem concentração de 4,5 mol/L, quer dizer que em cada litro da solução (não do solvente) tem-se dissolvidos 4,5 mols do soluto.
Porém, em laboratório é mais fácil conseguir a massa em gramas do soluto e a sua massa molar, do que a sua quantidade de máteria em mols.
Assim, sabendo-se que: 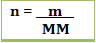 ou se referindo ao soluto:
ou se referindo ao soluto:
Podemos substituir o valor de n1 na fórmula da concentração em mol/L e teremos:

Considere o problema abaixo para ver como se usa essa fórmula a fim de determinar a concentração de uma solução:“Qual será a concentração em quantidade de matéria de uma solução que foi preparada dissolvendo-se 120 g de hidróxido de sódio em 2 L de água e obteve-se uma solução com 2 L?”Dados:
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol• Substituindo os valores dados na fórmula:
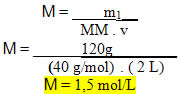
https://www.youtube.com/watch?v=D4fEHBYT7Kc
Aula 7
8ª/ 9ª semanas 19/03/2018 a 30/03/2018Situação de Aprendizagem 5 – Oxigênio dissolvido na água – uma questão da qualidade Competência e habilidades. Fazer usos da linguagem química; compreender a importância do oxigênio dissolvido no meio aquático; construir e aplicar o conceito de DBO e relacionar informações sobre DBO para entender problemas ambientais e poder enfrentar situações; interpretar informações de gráficos.
6. DBO
Significa Demanda Bioquímica de Oxigênio, ou seja, é a quantidade de oxigênio necessária para estabilizar a matéria orgânica.
A DBO é o parâmetro tradicionalmente mais usado para a caracterização de águas residuárias brutas e tratadas, como também para a caracterização da qualidade dos corpos d’água.
A quantidade de matéria orgânica presente, indicada pela DBO, é importante para se conhecer o potencial poluidor de um efluente, para o dimensionamento do sistema de tratamento mais adequado e medir a eficiência desse sistema.
Quanto maior o grau de poluição orgânica, maior a DBO do curso d’água.
DBOe = [Lo.(Qe + Qr) – DBOr x Qr] / QrOnde: DBOe = concentração máxima de DBO no efluente a ser lançado (mg L-1);
Lo. = DBO da mistura água do rio + efluente, no ponto de lançamento (mg L-1);Sendo:
Lo. = (DBOr x Qr + DBOe x Qe)/(Qr + Qe)Qe = vazão do efluente no ponto de lançamento (L s-1);
Qr = vazão do rio no ponto de lançamento (L s-1);DBOr = concentração de DBO na água do rio, a montante do’lançamento (mg L-1).P.S.: mg/L = ppm
O que é Demanda Bioquímica de Oxigênio?A função principal do nosso sistema de tratamento é receber o efluente e submete-lo a um processo biológico, tendo como objetivo minimizar a sua quantidade de D.B.O existente.
Mas o que é D.B.O?
D.B.O. significa Demanda Bioquímica de Oxigênio, ou seja, é a quantidade de oxigênio necessária para estabilizar a matéria orgânica. Quanto menor o nível de DBO, menos poluente é o efluente. Para efeitos comparativos:
A água pura tem 10ml/L de oxigênio dissolvido;Peixes sensíveis precisam de 5 a 6 ml/L de oxigênio para sobreviverem, enquanto que peixes mais resistentes, como o bagre, sobrevivem em 2 a 3 ml/L de oxigênio dissolvidos na água;
O esgoto doméstico precisa, para ser degradado, de aproximadamente 300ml/L de oxigênio (DBO). Após tratamento com o sistema Delta Ambiental, o efluente resultante tem em torno de apenas 30 ml/L de DBO, não causando danos ao meio ambiente se for disposto corretamente e atendendo as exigências legais.
O valor da Demanda Bioquímica de Oxigênio (DBO), é usado para estimar a carga orgânica dos efluentes e dos recursos hídricos, com esse valor é possível identificar a necessidade de aeração (oxigenação) para degradar essa materia orgânica nas ETE’s (Estações de Tratamento de Esgoto).
Demanda bioquímica de oxigênio é o parâmetro mais utilizado para a medida do consumo de oxigênio na água. Representa a quantidade de oxigênio do meio que é consumido pelos peixes e outros organismos aeróbicos e que gasta de oxidação de matéria orgânica presente na água. É medida a 20º C.
http://https:mundoeducacao.bol.uol.com.br/quimica/demanda-bioquimica-oxigenio.htm
EXERCÍCIOS DE FIXAÇÃO COPIAR E RESPONDER AS QUESTÕES NO CADERNO, A CANETA DEMONSTRADO OS CÁLCULOS, ALGUNS ESTÃO COM A RESPOSTA
Esta atividade é para fixação e compreensão dos conceitos para que seja possível a avaliação do Conhecimento adquirido ao longo do estudo do Tema.
1)Dissolve-se 20 g de sal de cozinha em água. Qual será o volume da solução, sabendo-se que a sua concentração é de 0,05 g/L?2)FAAP-SP- modificada) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contém 30 g de sal em 400 mL de solução.
3)Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?
4)Um técnico de laboratório preparou uma solução aquosa de ácido sulfúrico (H2SO4) misturando 33 g desse ácido em 200 mL de água, com extremo cuidado, lentamente, sob agitação e em uma capela com exaustor. Ao final, a solução ficou com um volume de 220 mL. A concentração em g/L dessa solução é:
5) (Unicamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de MgCl2 de concentração 8,0 g/L. Quantos gramas de soluto são obtidos?
6)Qual a concentração de uma solução contendo 40g de cloreto de sódio dissolvidos em 250 mL de solução? R:160
7) Uma solução foi preparada adicionando-se 40g de hidróxido de sódio em água suficiente para produzir 200 mL de solução. Calcule a concentração comum dessa solução. R:200
8) Calcule a concentração comum de uma solução de nitrato de prata, sabendo que ela encerra 120g do sal em 600 cm3 de solução. R:200
9)Determine a massa de ácido nítrico, em gramas, necessária para a preparação de 150 mL de uma solução de concentração 50g/L. R:7,5g
10) (Faap-SP) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contêm 30g de sal em 400 mL de solução. R:7,5
11) (Mack-SP) Qual a concentração, em g/L, da solução obtida ao se dissolverem 4g de cloreto de sódio em 50 cm3 de solução? R:80
12) São dissolvidos 24g de sacarose em água suficiente para 500mL de solução. Qual é a concentração comum dessa solução? R:48
13) Calcule a concentração comum de uma solução que apresenta volume de 800mL e contém 80g de soluto. R:100
14) (PUCCamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de cloreto de magnésio de concentração 8,0g/L. Quantos gramas de soluto são obtidos? R:2
15) São dissolvidos 200g de cloreto de sódio em água suficiente para 2 litros de solução. qual é a concentração comum dessa solução? R:100
16) 300g de açúcar foram adicionados a uma certa quantidade de água, obtendo-se uma solução 60g/L. Qual o volume dessa solução, em mL? R:5000
17) A concentração comum de uma solução é de 20g/L. Determine o volume, em mL, dessa solução, sabendo que ela contém 75g de soluto. R:3750
18) (UFSM-RS) O derramamento de óleo nos cursos d’água forma uma película que dificulta a absorção de oxigênio, o que provoca a destruição de algas e plânctons, prejudicando a alimentação dos peixes. De acordo com alguns órgãos ambientais, o limite máximo de óleo na água é de 30 mg/L. Com base nesse parâmetro, quantos gramas de óleo poderão estar presentes em 1m3 de água, sem comprometer o ecossistema? R:30
19)Determine a massa de NaOH, em gramas, dissolvido em água suficiente para 300 mL de solução, cuja concentração comum é de 700g/L. R:210
20) Um frasco de laboratório contém 2,0 L de uma solução aquosa de NaCl. A massa do sal dissolvida na solução é de 120g. Que volume, em L, deve ser retirado da solução inicial para que se obtenham 30g de sal dissolvido? R:0,5
21) (USJT-SP) O oxalato de cálcio é encontrado nas folhas de espinafre, nas sementes do tomate, e é um dos constituintes das pedras formadas nos rins (cálculo renal). Uma amostra (alíquota) de 25 cm3 de uma solução aquosa de oxalato de cálcio contém 0,2625g desse sal. Qual é a concentração comum de oxalato nessa solução?R:10,5
22) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de MgCl2 de concentração 8,0 g/L. Quantos gramas de MgCl2 são obtidos? Resposta: 2g
23)Uma solução foi preparada adicionando – se 40 g de NaOH em água suficiente para produzir 400 mL de solução. Calcule a concentração da solução em g/L. Resposta: 10 g/L
24)O ser humano adulto possui, em média, 5 litros de sangue com cloreto de sódio ( NaCl ) dissolvido na concentração de 5,8 g/L. Qual é a massa total de cloreto de sódio ( NaCl ) no sangue de uma pessoa adulta? Resposta: 29 g
25) Qual a concentração, em g/L, de uma solução resultante da dissolução de 50g de NaCl para um volume final de 200mL? Resposta: 250 g/L
26) Qual o volume final que deve ter uma solução para que tenha concentração igual a 10g/L a partir de 25g de soluto? Resposta: 2,5 L
27) Nosso suco gástrico é uma solução aquosa de HCl( ácido clorídrico ), com massa de 0,365 g para cada 1 litro. Com base nessa informação, determine a concentração molar (molaridade, mol/L ) do ácido clorídrico no suco gástrico.( Dado: massa molar do HCl = 36,5 g/mol). Resposta: 0,01 mol/L
28) Considere uma xícara com 200 mL de leite, ao qual se acrescentaram 6,84 g de açúcar comum. Qual será a concentração molar (molaridade), expressa em mols/ L, da solução formada? ( Dado: massa molar do açúcar comum (C12H22O11) = 342 g/mol.) Resposta: 0,1 mol/L
29) Em um balão volumétrico de 400 mL, são colocados 18 g de KBr e água suficiente para atingir a marca do gargalo (ou seja, completar 400 mL de solução). Qual é a concentração molar (quantidade de matéria por volume) dessa solução? (Dado: massa molar KBr=119g) Resposta: 0,37 mol/L
30)Qual a concentração de uma solução contendo 40g de cloreto de sódio dissolvidos em 250 mL de solução? R:160
31) Uma solução foi preparada adicionando-se 40g de hidróxido de sódio em água suficiente para produzir 200 mL de solução. Calcule a concentração comum dessa solução. R:200
32) Calcule a concentração comum de uma solução de nitrato de prata, sabendo que ela encerra 120g do sal em 600 cm3 de solução. R:200
33)Determine a massa de ácido nítrico, em gramas, necessária para a preparação de 150 mL de uma solução de concentração 50g/L. R:7,5g
34) (Faap-SP) Calcule a concentração, em g/L, de uma solução aquosa de nitrato de sódio que contêm 30g de sal em 400 mL de solução. R:7,5
35) (Mack-SP) Qual a concentração, em g/L, da solução obtida ao se dissolverem 4g de cloreto de sódio em 50 cm3 de solução? R:80
36) São dissolvidos 24g de sacarose em água suficiente para 500mL de solução. Qual é a concentração comum dessa solução? R:48
37) Calcule a concentração comum de uma solução que apresenta volume de 800mL e contém 80g de soluto. R:100
38) (PUCCamp-SP) Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de cloreto de magnésio de concentração 8,0g/L. Quantos gramas de soluto são obtidos? R:2
39) São dissolvidos 200g de cloreto de sódio em água suficiente para 2 litros de solução. qual é a concentração comum dessa solução? R:100
40) (UFSM-RS) O derramamento de óleo nos cursos d’água forma uma película que dificulta a absorção de oxigênio, o que provoca a destruição de algas e plânctons, prejudicando a alimentação dos peixes. De acordo com alguns órgãos ambientais, o limite máximo de óleo na água é de 30mg/L. Com base nesse parâmetro, quantos gramas de óleo poderão estar presentes em 1m3 de água, sem comprometer o ecossistema? R:30
Aula 8
10ª/11ª Fechamento e avaliação, recuperação do 1° bimestre será realizada nas
Aula 9
semanas:11ª semana 16/04 a 20/04/2018
Orientação e revisão do 1 bimestre, a respeito do conteúdo. Auto avaliação do professor e aluno.
Aula 10
Introdução
Embora em lugares do interior do Brasil ainda existam comunidades que vivem sem energia elétrica, não há como negar que se depende muito dela. Sua falta acarreta, geralmente, um enorme transtorno. O conhecimento dos fenômenos elétricos e seu domínio contribuíram (e ainda contribuem) como avanço das ciências, além de ter permitido a melhora na qualidade de vida das pessoas.
O QUE VOCÊ JÁ SABE?
Ao pentear os cabelos em dias secos, é comum que os fios fiquem “rebeldes”, levantando e grudando no pente. Você já viu esse fenômeno acontecer? Já pensou sobre ele?
Os fenômenos elétricos são conhecidos desde a Antiguidade. Em 600 a.C.,o filósofo grego Tales de Mileto observou que uma resina natural,o âmbar, depois de entrar em atrito com a lã, atraí apenas e cascas de cereais. Assim, com a observação dessas forças de atração e repulsão, iniciaram-se os primeiros estudos dos fenômenos elétricos.
O conhecimento das características das cargas elétricas foi determinante no desenvolvimento dos modelos atômicos.Agora, você vai iniciar o estudo sobre os fenômenos elétricos realizando alguns experimentos.
É recomendável fazê-los em um dia em que a umidade do ar esteja baixa, ou seja, em um dia “seco”. Você vai precisar de:
- Dois bastões de plástico, que podem ser canetas esferográficas sem a carga e a tampa;
- um bastão de vidro;
- um pedaço de tecido de lã;
- um pedaço de papel-alumínio;
- uma bolinha de isopor;
- linhas de costura;
- um suporte.
Cubra a bolinha de isopor com uma camada de papel-alumínio e pendure-a no suporte, como mostra a figura ao lado (passo 1). Atrite (esfregue) o bastão de vidro com o tecido de lã e aproxime-o da bolinha, sem encostar (passos 2 e 3). Observe o que ocorre. Repita o mesmo procedi- mento com o bastão de plástico (passos 4 e 5).
Observe o que acontece.
Como você deve ter notado, os dois bastões, quando atritados com o tecido de lã, atraem a bolinha e, depois, a repelem.
Experimento sobre eletrização II
Agora, como mostram as figuras da próxima página, você deve começar atritando o bastão de vidro com o tecido de lã
(passo 1). Pendure o bastão de plástico e aproxime dele o bastão de vidro, sem encostar
(passo2). Anote o que observou.Repita o procedimento anterior só que, dessa vez, deixe o bastão de vidro de lado e utilize um outro bastão de plástico. Atrite-o com o tecido de lã e aproxime-o do bastão de plástico que está pendurado no suporte, sem encostar
(passos 3 e 4). Observe o que ocorre.No primeiro caso, percebe-se que o bastão de vidro atrai o bastão de plástico. No segundo, quando os dois bastões de plástico se aproximam um do outro, eles se repelem.Como explicar o que ocorre nos experimentos?
O fenômeno observado foi explicado já no século XVIII, considerando-se que no bastão de vidro surge uma carga elétrica, que foi chamada de carga vítrea, e no bastão de plástico, uma carga elétrica, que foi chamada de carga resinosa; na época, o bastão era de âmbar, uma resina.
Mais tarde, por convenção, a carga vítrea passou a ser chamada carga positiva, e a carga resinosa, carga negativa.
Depois do atrito do bastão de vidro com o tecido de lã, ele adquire cargas positivas e a lã adquire cargas negativas; no caso do atrito do bastão de plástico com a lã, ele adquire cargas elétricas negativa se a lã fica positivamente carregada.
Uma das características das cargas elétricas é que cargas iguais se repelem e cargas diferentes se atraem, ou seja, cargas positivas são repelidas pelas cargas positivas e atraídas pelas cargas negativas, e vice-versa.
Toda matéria é formada por cargas positivas e negativas, na mesma quantidade, o que dá o caráter neutro dos materiais. Assim, ao aproximar a bolinha dos bastões carregados, ela é eletrizada e sofre atração pelos bastões, não importando de que material eles são, como a ilustração a seguir mostra:
Experimento sobre eletrização I.Como pode ser observado na ilustração, a bolinha está com carga neutra por apresentar o mesmo número de cargas elétricas positivas e negativas. Ao se aproximar um bastão carregado, as cargas elétricas da esfera se separam e ela é atraída.
Se o bastão estiver carregado positivamente, as cargas positivas dele repelem as cargas positivas da bolinha e atraem suas cargas negativas. O mesmo ocorre se você aproximar o bastão de plástico (ou a caneta) carregado negativa- mente: suas cargas negativas repelem as cargas negativas da bolinha e atraem as positivas.
Quando se afasta da bolinha o bastão (de plástico ou de vidro), as cargas se redistribuem e ela recupera sua neutralidade. Se qualquer um dos bastões encostar-se à bolinha, ela vai adquirir a carga dele, sendo, então, repelida Agora, você vai iniciar o estudo sobre os fenômenos elétricos realizando alguns experimentos.
É recomendável fazê-los em um dia em que a umidade do ar esteja baixa, ou seja, em um dia “seco”.
Aula 13
15ª semana 14/05 a 18/05/2018
Situação de Aprendizagem 9 – Explicando o comportamento de materiais; modelos sobre a estrutura da matéria.CONTEÚDOS E TEMAS: Natureza elétrica da matéria – condutividade elétrica dos materiais, isolantes e condutores.
COMPETÊNCIA E HABILIDADES.Classificação e estabelecimento de critérios; controle de variáveis; elaboração de modelo explicativos; ideias de Thomson, Rutheford e Bohr; Tabela periódica – estrutura e propriedades dos elementos.
Aula 14
16ª semana 21/05 a 25/05/2018
Situação de Aprendizagem 10 – Explicando o comportamento de materiais; as ligações entre átomos, íons e moléculas.
CONTEÚDOS E TEMAS:Forças de atração e de repulsão elétrica; ligações químicas; localização dos metais e não metais na tabela periódica.
COMPETÊNCIA E HABILIDADES. Interpretar a ligação química em termos das atrações e repulsões entre elétrons e núcleos, relacionando as propriedades das substâncias de maneira a ampliar o entendimento do mundo físico; reconhecer a ideia de ligação química como modelo explicativo.
Aula 15
17ª semana 28/05 a 01/06/2018
Situação de Aprendizagem 11 Transformações químicas; uma questão de quebra e formação de ligações.
CONTEÚDOS E TEMAS: Ligações químicas; modelo explicativo para transformação química; energia de ligação; modelo explicativo para transformações químicas exotérmicas e endotérmicas.
COMPETÊNCIA E HABILIDADES. Empregar a linguagem química; interpretar a transformação química como a quebra e formação de ligações; compreender e identificar a energia envolvida na quebra e formação de ligações químicas, fazer previsões a respeito da energia envolvida numa transformação química.
Aula 16
18ª semana 04/06 a 08/06/2018
Situação de Aprendizagem 12 – Representando a energia envolvida nas transformações; o uso de diagramas de energia.
CONTEÚDOS E TEMAS:Diagramas de energia; calor de reação; reação exotérmicas e endotérmicas.
COMPETÊNCIA E HABILIDADES.Fazer uso da linguagem química; compreender, utilizar e saber construir gráficos de energia.DISCIPLINA: QUÍMICA – 2° SÉRIE – 3° BIMESTRE.
Distribuição Eletrônica
Camadas Eletrônicas ou Níveis de Energia
A coroa ou eletrosfera está dividida em 7 camadas designadas por K, L, M, N, O, P, Q ou pelos números: n = 1, 2, 3, 4, 5, 6, 7.
O número de camada é chamado número quântico principal (n).
Número máximo de elétrons em cada nível de energia:
1. Teórico:
Equação de Rydberg: x = 2n2
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 50 | 72 | 98 |
- Experimental:
O elemento de número atômico 112 apresenta o seguinte número de elétrons nas camadas energéticas:
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 32 | 18 | 2 |
Camada de valência é a camada mais externa do átomo e pode contar no máximo 8 elétrons
Subcamadas ou Subníveis de Energia
Uma camada de número n será subdividida em n subníveis:
s, p, d, f, g, h, i…
Nos átomos dos elementos conhecidos, os subníveis teóricos g, h, i… estão vazios.
Número máximo de elétrons em cada subnível experimental:
| s | p | d | f |
| 2 | 6 | 10 | 14 |
Distribuição dos elétrons nos subníveis (configuração eletrônica)
Os subníveis são preenchidos em ordem crescente de energia (ordem energética). Linus Pauling descobriu que a energia dos subníveis cresce na ordem:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
É nessa ordem que os subníveis são preenchidos. Para obter essa ordem basta seguir as diagonais no Diagrama de Pauling abaixo:
Seqüência de preenchimento de orbitais
Deve-se observar a ordem energética dos subníveis de energia, que infelizmente não é igual à ordem geométrica. Isso porque subníveis de níveis superiores podem ter menor energia total do que subníveis inferiores. A energia de um subnível é proporcional à soma (n + l) de seus respectivos números quânticos principal (n) e secundário (l).
O número quântico azimutal ou secundário, representado pela letra l, especifica a subcamada e, assim, a forma do orbital. Pode assumir os valores 0, 1, 2 e 3, correspondentes às subcamadas s, p, d, f.
Método analítico para ordenação dos subníveis:
Exemplos
1) (n + l)
3d 4s
n = 3 n = 4
l = 2 l = 0
n + l = 3 n + l = 4
3d é mais energético que 4s
2)
3d 4p
n = 3 n = 4
l = 2 l = 1
n + l = 5 n + l = 5
Quando os subníveis apresentarem a mesma soma, o mais afastado ou de maior nível energético terá maior energia.
Ordem geométrica é a ordenação crescente de níveis energéticos.
Exemplo: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p…
Camada de Valência é o último nível de uma distribuição eletrônica, normalmente os elétrons pertencentes à camada de valência, são os que participam de alguma ligação química.
Exemplo: Arsênio (As): Z = 33
– Ordem energética (ordem de preenchimento): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
– Ordem geométrica (ordem de camada): 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Camadas Energéticas: K = 2; L = 8; M = 18; N = 5
A camada de valência do As é a camada N, pois é o último nível que contém elétrons.
Distribuição Eletrônica em Íons
Átomo: nº de prótons = nº de elétrons
Íon: nº de prótons (p) ≠ nº de elétrons
Íon positivo (cátion): nº de p > nº de elétrons
Íon negativo (ânion): nº de p < nº de elétrons
Distribuição Eletrônica em Cátion
Retirar os elétrons mais externos do átomo correspondente. Exemplo:
Ferro (Fe) Z = 26 → 1s2 2s2 2p6 3s2 3p6 4s2 3d6 (estado fundamental = neutro)
Fe2+ → 1s2 2s2 2p6 3s2 3p6 3d6 (estado iônico)
Distribuição Eletrônica em Ânion
Colocar os elétrons no subnível incompleto. Exemplo:
Oxigênio (O) Z = 8 → 1s2 2s2 2p4 (estado fundamental = neutro)
O2- → 1s2 2s2 2p6
Os números átomos.
Existem quatro números quânticos: quânticos descrevem a posição (e a energia) dos elétrons nos
Número quântico principal: indica o nível (camada) de energia.
Número quântico secundário ou azimutal: indica o sub-nível de energia.
Número quântico magnético: indica o orbital.
Número quântico de spin: indica a orientação do elétron no orbital.
Dois elétrons nunca terão os quatro números quânticos iguais, pois mesmo que estejam no mesmo nível, no mesmo sub-nível e no mesmo orbital, terão spins opostos. Assim, qualquer par de elétrons pode ter até três números quânticos iguais.
- Número quântico principal, n
O número quântico principal terá como valores 1, 2, 3, 4…de acordo com o nível eletrônico que o elétron se encontra.
- Número quântico azimutal, l
O número quântico azimutal, informa-nos sobre a forma dos orbitais (s, p, d, f). Para um dado valor de n, l pode ter como valores possíveis os números inteiros de 0 a (n − 1). Para os sub-níveis s, p d, f, temos:
s = 0, p = 1 , d = 2 , f = 3
- Número quântico magnético, ml
O número quântico magnético especifica a orientação permitida para uma nuvem eletrônica no espaço, sendo que o número de orientações permitidas está diretamente relacionado à forma da nuvem (designada pelo valor de l). Dessa forma, este número quântico pode assumir valores inteiros de -l, passando por zero, até +l. Para os sub-níveis s, p d, f, temos:
| s | 0 | ||||||
| p | -1 | 0 | +1 | ||||
| d | -2 | -1 | 0 | +1 | +2 | ||
| f | -3 | -2 | -1 | 0 | +1 | +2 | +3 |
- Número quântico de spin, ms
O número quântico de spin indica a orientação do elétron ao redor do seu próprio eixo. Como existem apenas dois sentidos possíveis, este número quântico assume apenas os valores -1/2 e +1/2.
- Exemplos: Quais os nºs quânticos do último elétron (elétron diferencial, verificador) de cada átomo abaixo?
Al = 1s22s22p63s23p1
Logo os nºs quânticos são referentes ao elétron de 3p1:
n = 3 (terceiro nível)
l = 1 (sub-nível p)
ml = -1 (primeiro orbital p)
ms = -1/2 (rotação)
Fe = 1s22s22p63s23p64s23d6
Logo os nºs quânticos são referentes ao elétron de 3d6:
n = 3 (terceiro nível)
l = 2 (sub-nível d)
ml = -2 (primeiro orbital d)
ms = +1/2 (rotação)
Aula 17
Semana
SITUAÇÃO DE APRENDIZAGEM 1 FORÇAS DE INTERAÇÃO ENTRE PARTÍCULAS QUE COMPÕEM OS ESTADOS SÓLIDO, LÍQUIDO E GASOSO
Conteúdos e temas: interações entre íons, átomos e moléculas: volatilidade, temperaturas de fusão e de ebulição e forças de interação.
Competências e habilidades: construir e interpretar o conceito de forças interpartículas, relacionando-as às propriedades das substâncias iônicas, moleculares e metálicas; aplicar
os conhecimentos adquiridos em situações do cotidiano que envolvem diferentes tipos de
interação.
Sugestão de estratégias de ensino: trabalho em grupo; análise de tabelas; interpretação de gráficos;
aulas expositivas dialogadas; pesquisas; atividade prática; elaboração de textos; seminários.
Sugestão de recursos: material para atividade prática; atividades propostas.
Sugestão de avaliação: questões propostas; elaboração de texto; busca em fontes de informação;
apresentação de seminários; atividade-síntese.
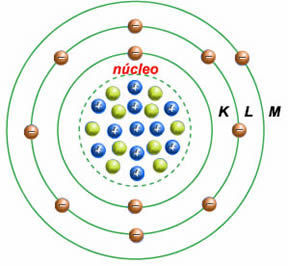
No ano de 1913, o dinamarquês especialista em física atômica Niels Bohr (1885-1962) estabeleceu o modelo atômico sistema planetário que é usado atualmente.
Bohr chegou a esse modelo baseando-se no dilema do átomo estável. Ele acreditava na existência de princípios físicos que descrevessem os elétrons existentes nos átomos.
Esses princípios ainda eram desconhecidos e graças a esse físico passaram a ser usados.
Bohr iniciou seus experimentos admitindo que um gás emitia luz quando uma corrente elétrica passava nele. Isso se explica pelo fato de que os elétrons, em seus átomos, absorvem energia elétrica e depois a liberam na forma de luz. Sendo assim, ele deduziu que um átomo tem um conjunto de energia disponível para seus elétrons, isto é, a energia de um elétron em um átomo é quantizada.
Esse conjunto de energias quantizadas mais tarde foi chamado de níveis de energia.Com essas conclusões Bohr aperfeiçoou o modelo atômico de Rutherford e chegou ao modelo do átomo como sistema planetário, onde os elétrons se organizam na eletrosfera na forma de camadas.
Conceito de Bohr: Os elétrons estão distribuídos em camadas ao redor do núcleo. Existem 7 camadas eletrônicas, representadas pelas letras maiúsculas: K, L, M, N, O, P e Q.
À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados. As camadas da eletrosfera representam os níveis de energia da eletrosfera.Assim, as camadas K, L, M, N, O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo que lembra a órbita de um planeta, com elétrons orbitando ao redor do “núcleo-sol”.
Aula 18
Semana
Camada de valência.
A camada de valência é o nível mais afastado do núcleo de um átomo e pode ser determinada por meio de distribuição eletrônica ou pela tabela periódica.
A camada de valência é a camada mais externa que um átomo pode apresentar, ou seja, é a camada mais distante do núcleo de um átomo. Uma das formas de determiná-la é por meio da distribuição eletrônica fundamental no diagrama de Linus Pauling. Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Exemplo 1: Átomo de sódio (11Na)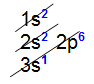 Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)
Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)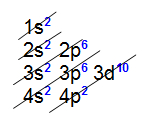 Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U)
Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U).jpg) Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
Aula 19
semana
Camada de valência e a tabela periódica. Podemos ainda determinar a camada de valência por meio do período e da família do elemento na Tabela Periódica.
a) Período O período (coluna horizontal, numerada de 1 a 7) em que o elemento está é a sua camada de valência.
Exemplo 1: Átomo de estanho (Sn) O estanho está localizado no quinto período da tabela periódica, logo, sua camada de valência é a quinta.
Exemplo 2: Átomo de bário (Ba) O bário está localizado no sexto período da tabela periódica, logo, sua camada de valência é a sexta.
Exemplo 3: Átomo de meitnério(Mt) O meitnério está localizado no sétimo período da tabela periódica, logo, sua camada de valência é a sétima.
b) Família A Quando o elemento pertence à família A, o número da família sempre será o número de elétrons na camada de valência, distribuídos nos subníveis s (limite de 2 elétrons) e p (limite de 6 elétrons).
Exemplo 1: Átomo de estanho (Sn) O estanho está localizado na família IVA da tabela periódica, logo, sua camada de valência apresenta quatro elétrons (dois estão presentes no subnível s e dois estão no subnível p).
Exemplo 2: Átomo de bário (Ba) O bário está localizado na família IIA da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no subnível s).
c) Família B Independentemente da família B a que o elemento pertença, sua camada de valência sempre apresentará 2 elétrons (no subnível s).
Exemplo 1: Átomo de meitnério (Mt) O meitnério está localizado na família VIIB da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no subnível s).
Exemplo 2: Átomo de cobre (Cu) O cobre está localizado na família IB da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no
Aula 20
Semana
Exercícios Sobre A Camada De Valência
Questão 1
O ouro foi um dos primeiros elementos a serem descobertos pelo homem (2600 a.C), junto com o carbono, mercúrio, ferro, prata, cobre e outros. Por volta de 1400 a.C., o ouro teve sua aplicação no Egito e era usado para valorizar os sarcófagos das múmias dos faraós. Por esse e outros motivos, o ouro mereceu lugar de destaque por ser um metal precioso de beleza característica. Esse metal pode ser encontrado livremente na natureza, conhecido como ouro nativo. Estima-se que existam cinco quilates de ouro para cada milhão de toneladas de terra, por isso esse elemento é tão raro. Analisando as características atômicas, qual seria a camada de valência de um átomo de ouro?
a) [Xe] 6s2, 5d7
b) [Xe] 6s2, 5d9
c) [Xe] 6s2, 5d8
d) [Xe] 5d10
e) [Xe] 5d10
.jpg)
Questão 2
a) 1
b) 2
c) 3
d) 4
e) 5
Questão 3
a) 2
b) 6
c) 8
d) 10
e) 18

Questão 4
a) [Ar] 3d4
b) [Ar] 3d6
c) [Ar] 4s1, 3d3
d) [Ar] 4s2, 3d2
e) [Ar] 4s2, 3d5
Aula 21
Semana
Íons
Os íons são átomos que ganham ou perdem elétrons durante uma reação, podendo ser classificado em: ânions ou cátions.Na+ e Cl–
Você sabe o que significa os sinais positivo e negativo destes elementos?
Eles aparecem para indicar a presença de íons, neste caso se trata dos íons participantes da reação de formação do Cloreto de Sódio:Na+ + Cl– ↔ NaCl A seta indica que a reação é reversível.
Os íons explicam porque o composto é formado: o átomo de sódio (Na) não é estável, pois apresenta 1 elétron livre na camada de valência, a estabilidade só será atingida se ele perder um elétron, o que dará origem ao cátion Na+.
O átomo de cloro (Cl-) por sua vez também não é estável, pelos mesmos motivos que o Na, e atingirá a estabilidade somente se ganhar um elétron, esse átomo dá origem ao íon Cl-.
Sendo assim, a ligação iônica surge através da interação eletrostática e obedece a regra: cargas com sinais opostos se atraem.
Os compostos iônicos adquirem estrutura eletronicamente neutra por possuírem a mesma quantidade de prótons e elétrons, mas os íons formadores, pelo contrário: são reativos e instáveis.
Resumindo: Íons são átomos que perdem ou ganham elétrons durante reações, eles se classificam em ânions e cátions
:Ânion (íon negativo): átomo que recebe elétrons e fica carregado negativamente.Exemplos:F-1, O-2.Cátion (íon positivo): átomo que perde elétrons e adquire carga positiva.
Exemplos:Mg+2, Pb+4.Exemplos de ionização de elementos químicos:9F → 9F-Átomo neutro recebe 1 elétron O átomo de Flúor (F) se encontrava eletricamente neutro, mas como ganhou 1 elétron passou a se apresentar como um Ânion.
Átomo neutro perde 2 elétrons O átomo de Cálcio (Ca) perdeu 2 elétrons e passou a ser um cátion.40Ca → 40Ca2+
Aula 22
Semana
Regra do Octeto
A Regra do Octeto estabelece que os átomos dos elementos ligam-se uns aos outros na tentativa de completar a sua camada de valência (última camada da eletrosfera). A denominação “regra do octeto” surgiu em razão da quantidade estabelecida de elétrons para a estabilidade de um elemento, ou seja, o átomo fica estável quando apresentar em sua camada de valência 8 elétrons.Para atingir tal estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, dessa forma eles adquirem oito elétrons na camada de valência. Exemplo: Repare que os átomos de Oxigênio se ligam para atingirem a estabilidade sugerida pela Regra do Octeto. As diferentes cores de eletrosfera mostradas na figura nos ajudam a interpretar o seguinte:1. Átomos de Oxigênio possuem seis elétrons na camada de valência (anel externo na figura).2. Para se tornarem estáveis precisam contar com 8 elétrons, o que fazem então? Compartilham dois elétrons (indicado na junção dos dois anéis), formando uma molécula de gás Oxigênio (O2).A justificativa para essa regra é que as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com oito elétrons (configuração de um gás nobre). É por isso que os elementos tendem sempre a formar ligações na busca de tal estabilidade.Existem exceções para a Regra do Octeto, alguns compostos não precisam ter oito elétrons na camada de valência para atingir a estabilidade, vejamos quais:Berílio (Be)
Repare que os átomos de Oxigênio se ligam para atingirem a estabilidade sugerida pela Regra do Octeto. As diferentes cores de eletrosfera mostradas na figura nos ajudam a interpretar o seguinte:1. Átomos de Oxigênio possuem seis elétrons na camada de valência (anel externo na figura).2. Para se tornarem estáveis precisam contar com 8 elétrons, o que fazem então? Compartilham dois elétrons (indicado na junção dos dois anéis), formando uma molécula de gás Oxigênio (O2).A justificativa para essa regra é que as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com oito elétrons (configuração de um gás nobre). É por isso que os elementos tendem sempre a formar ligações na busca de tal estabilidade.Existem exceções para a Regra do Octeto, alguns compostos não precisam ter oito elétrons na camada de valência para atingir a estabilidade, vejamos quais:Berílio (Be)
Átomo capaz de formar compostos com duas ligações simples, sendo assim, estabiliza-se com apenas quatro elétrons na camada de valência.Boro (B)
Forma substâncias moleculares com três ligações simples, ficando estável com seis elétrons na última camada.Alumínio (Al)
É uma exceção à Regra do Octeto pelos mesmos motivos que o Boro, atinge a estabilidade com seis elétrons na camada de valência.
Aula 23
Semana
Ligação Iônica
Ligação iônica é uma interação entre átomos na qual ocorre a perda e o ganho de elétrons, resultando em compostos com características e fórmulas bem particulares.

O cloreto de sódio é um exemplo de composto formado a partir de ligação iônica entre os átomosLigação iônica é o nome dado a uma das três formas como os átomos podem interagir entre si. As outras formas de interação entre átomos são a ligação covalente, que ocorre entre átomos de ametais, hidrogênios, ou ametal e hidrogênio, e a ligação metálica, a qual acontece somente entre átomos de um mesmo metal.Os átomos dos elementos químicos que participam da ligação iônica devem apresentar, obrigatoriamente, a natureza de ganhar ou perder elétrons, assim, a ligação iônica pode ocorrer entre:
- um metal e um ametal;
- um metal e o hidrogênio.
As fórmulas dos compostos formados a partir de ligação iônica sempre apresentam um padrão YX, em que o Y sempre será o elemento metálico.Dessa forma, para identificar um composto iônico, basta verificar se a fórmula inicia com um elemento metálico.Princípio da ligação iônica Para um melhor entendimento de como ocorre uma ligação iônica, vamos utilizar a substância iônica mais conhecida entre nós, o cloreto de sódio (NaCl).Nesse composto iônico, estão os elementos:
- Sódio: elemento metálico, pois possui característica de perder elétron; pertencente à família IA, de número atômico 11, com um elétron na camada de valência, como podemos observar na distribuição eletrônica abaixo:
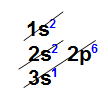 Distribuição eletrônica do elemento sódio A perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).
Distribuição eletrônica do elemento sódio A perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).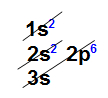 Nova camada de valência do elemento sódio
Nova camada de valência do elemento sódio
- Cloro: elemento ametálico, pois possui característica de ganhar elétron; pertencente à família VIIA, de número atômico 17, com sete elétrons na camada de valência, como podemos observar na distribuição eletrônica abaixo:
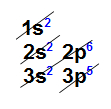 Distribuição eletrônica do elemento cloroO ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência.
Distribuição eletrônica do elemento cloroO ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência. Nova camada de valência do elemento cloroObs.: Assim, de uma forma geral, seguindo a regra do octeto, na ligação iônica, o metal, ao perder seus elétrons na camada de valência, torna-se estável, pois passará a ter uma nova camada de valência com dois (desde que seja no primeiro nível) ou oito elétrons.Com os ametais ou o hidrogênio não é diferente, pois, ao ganhar elétrons, passarão a ter dois ou oito elétrons na camada de valência.Construção das fórmulas químicas dos compostos formados por ligação iônicaPara construir a fórmula de uma substância formada a partir da ligação iônica, devemos obedecer o seguinte padrão:
Nova camada de valência do elemento cloroObs.: Assim, de uma forma geral, seguindo a regra do octeto, na ligação iônica, o metal, ao perder seus elétrons na camada de valência, torna-se estável, pois passará a ter uma nova camada de valência com dois (desde que seja no primeiro nível) ou oito elétrons.Com os ametais ou o hidrogênio não é diferente, pois, ao ganhar elétrons, passarão a ter dois ou oito elétrons na camada de valência.Construção das fórmulas químicas dos compostos formados por ligação iônicaPara construir a fórmula de uma substância formada a partir da ligação iônica, devemos obedecer o seguinte padrão:
- Determinar a carga do cátion;
- Determinar a carga do ânion;
- Cruzar as cargas, de forma que a carga do cátion seja o índice atômico (número à direita da sigla) do ânion, e vice-versa.
1º Exemplo: Fórmula com os elementos alumínio e bromo.
- Alumínio: é um metal, por isso, tem a tendência de perder elétron; da família IIIA, pois possui três elétrons na camada de valência, logo, sua carga é +3;
- Bromo: é um ametal, por isso, tem a tendência de ganhar elétron; da família VIIA, pois possui sete elétrons na camada de valência, logo, sua carga é -1;
- O número 3, referente à carga do alumínio, será o índice do bromo, e o número 1, referente à carga do bromo, será o índice do alumínio.
Como a carga do alumínio é +3 e a do bromo é -1, assim, a fórmula do composto iônico será AlBr3.2º Exemplo: Fórmula com os elementos magnésio e hidrogênio.
- Magnésio é um metal, por isso, tem a tendência de perder elétron; da família IIA, pois possui dois elétrons na camada de valência, portanto, sua carga é +2;
- Hidrogênio: não é ametal, porém, quando próximo a um metal, apresenta a tendência de ganhar elétron; não pertence a nenhuma família, pois possui um elétron na camada de valência. Assim, sua carga é -1;
- O número 2, referente à carga do magnésio, será o índice do hidrogênio, e o número 1, referente à carga do hidrogênio, será o índice do magnésio.
Como a carga do magnésio é +2 e a do hidrogênio é -1, logo, a fórmula do composto iônico será MgH2.
Características dos compostos químicos formados por ligação iônica
De uma forma geral, os compostos iônicos, isto é, substâncias formadas mediante ligação iônica, apresentam as seguintes características:
- São sólidos à temperatura ambiente;
- Seus átomos organizam-se de uma maneira a produzir um retículo cristalino (um cristal).
Obs.: Nos compostos iônicos, os átomos aglomeram-se de forma a ocupar os vértices de estruturas cristalinas. No cloreto de sódio, por exemplo, um ânion cloreto (esfera roxa) interage ao mesmo tempo com seis cátions sódio (esferas verdes): Representação da estrutura cristalina do cloreto de sódio
Representação da estrutura cristalina do cloreto de sódio
- São solúveis em água;
- São capazes de realizar o fenômeno da dissociação (liberação de íons) quando sofrem fusão, ou seja, quando passam do estado sólido para o estado líquido, ou quando estão dissolvidos em água;
- Apresentam elevados pontos de fusão e de ebulição;
- Possuem brilho;
- Conduzem corrente quando dissolvidos em água ou após sofrerem o processo de fusão.
Aula 24
semana
Ligação CovalenteA ligação covalente é um tipo de ligação química realizada entre os átomos de hidrogênio, ametais e semimetais que compartilham entre si pares de elétrons.
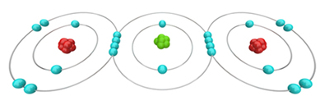
O dióxido de carbono é formado por ligações covalentes entre o carbono e dois átomos de oxigênio
A ligação covalente é um tipo de ligação química que ocorre com o compartilhamento de pares de elétrons entre átomos que podem ser o hidrogênio, ametais ou semimetais.
Segundo a teoria ou regra do octeto, os átomos dos elementos ficam estáveis quando atingem a configuração eletrônica de um gás nobre, ou seja, quando eles possuem oito elétrons em sua camada de valência (camada mais externa) ou dois elétrons — no caso de possuírem somente a camada eletrônica K.
Assim, seguindo essa regra, os átomos dos elementos mencionados possuem a tendência de ganhar elétrons para alcançarem a estabilidade.
Por exemplo, o hidrogênio no estado fundamental possui somente um elétron na sua camada eletrônica; assim, para ficar estável, ele precisar receber mais um elétron de outro átomo.
Se tivermos dois átomos de hidrogênio, ambos precisarão receber um elétron cada.Por isso, em vez de transferirem elétrons (como ocorre na ligação iônica), eles farão uma ligação covalente em que compartilharão um par de elétrons.Desse modo, ambos ficarão com dois elétrons, adquirindo a estabilidade:
Ligação covalente de formação do gás hidrogênioEssa forma de representar as ligações químicas, em que os elétrons da camada de valência são colocados ao redor do símbolo do elemento como “pontinhos”, é chamada de fórmula eletrônica de Lewis.Nela, cada par de elétrons compartilhado em uma ligação covalente é representado por um “enlaçamento” entre os dois pontinhos.Existe outra forma de representar as ligações covalentes, que é por meio da fórmula estrutural.Nessa fórmula, cada par compartilhado é representado por um traço.Veja:
Representação das ligações covalentes em fórmulas estruturais.Assim, a ligação que forma o gás hidrogênio é representada da seguinte forma:H─H.E sua fórmula molecular é H2.Visto que o hidrogênio é capaz de realizar somente uma ligação covalente, dizemos que ele é monovalente.Veja na tabela a seguir a quantidade de ligações covalentes que os principais ametais e semimetais podem realizar: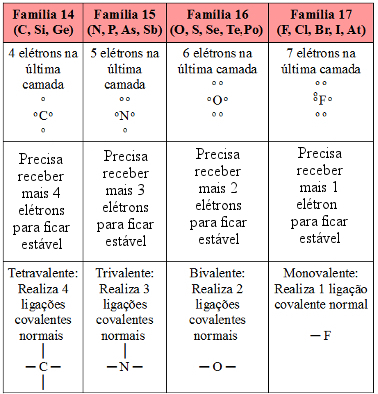
Possibilidades de realização de ligação covalente dos ametais e semimetais principais da Tabela Periódica.Com base nisso, consideremos agora a molécula de dióxido de carbono (CO2).
O carbono, que pertence à família 14, possui quatro elétrons na última camada, como mostrado na tabela, e precisa fazer quatro ligações covalentes para ficar estável.Já o oxigênio é da família 16, possui seis elétrons na camada de valência e precisa realizar duas ligações.
Desse modo, o carbono compartilha dois pares de elétrons ou faz duas ligações duplas com cada átomo de oxigênio.
Veja como ficam as fórmulas eletrônica e estrutural, respectivamente, do dióxido de carbono:Fórmula eletrônica e estrutural do dióxido de carbono 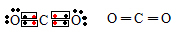
Exemplos de ligações covalentes (fórmulas eletrônicas)Veja mais exemplos a seguir:
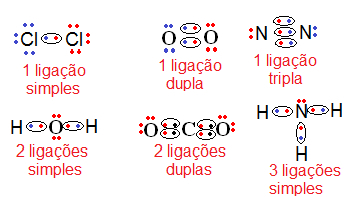
Exercícios Sobre Ligações Covalentes
As ligações covalentes são aquelas em que os átomos dos elementos que precisam receber elétrons para ficar estáveis realizam um compartilhamento por pares de elétrons.Questão 1Abaixo temos as fórmulas de Lewis para átomos de cinco elementos químicos.
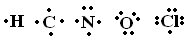 Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que a única estrutura que não se forma é:
Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que a única estrutura que não se forma é:a) HCl
b) Cl2
c) H2O
d) NH3
e) HC4
.jpg)
Fórmulas eletrônica e estrutural do metano
Questão 2
8B: 2 – 6
Representação da fórmula eletrônica de Lewis de uma molécula genéricaPortanto, a fórmula molecular nesse caso é: AB2.
.jpg)
|
C
//
O Cl
Questão 4
Formação do íon hidrônio
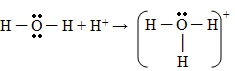
Ligação covalente dativa
A ligação covalente dativa ocorre quando um átomo transfere elétrons, essa transferência é indicada pelo vetor (seta).
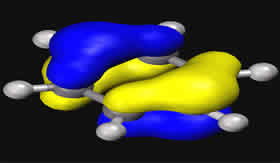
Ligação covalente dativa ocorre quando um átomo compartilha seus elétrons. Essa ligação obedece à Teoria do Octeto, onde os átomos se unem tentando adquirir oito elétrons na camada de valência para atingir a estabilidade eletrônica.Exemplo: formação de dióxido de enxofre (SO2) O átomo de enxofre (S) adquire seu octeto através da ligação com o oxigênio localizado à esquerda (ligação dupla coordenada). O oxigênio à direita necessita de elétrons para completar a camada de valência, e então o enxofre doa um par de elétrons para esse oxigênio. Essa transferência de elétrons é indicada pelo vetor (seta) e corresponde à ligação covalente dativa.Vejamos o compartilhamento de elétrons na formação do composto Sulfato, onde um átomo central de enxofre estabelece ligações covalentes com quatro átomos de oxigênio.
O átomo de enxofre (S) adquire seu octeto através da ligação com o oxigênio localizado à esquerda (ligação dupla coordenada). O oxigênio à direita necessita de elétrons para completar a camada de valência, e então o enxofre doa um par de elétrons para esse oxigênio. Essa transferência de elétrons é indicada pelo vetor (seta) e corresponde à ligação covalente dativa.Vejamos o compartilhamento de elétrons na formação do composto Sulfato, onde um átomo central de enxofre estabelece ligações covalentes com quatro átomos de oxigênio. As setas vermelhas indicam as ligações dativas e os traços indicam o compartilhamento de elétrons. Na ligação dativa, o átomo de enxofre “doa” um par de elétrons para cada átomo de oxigênio, estes, por sua vez, atingem a estabilidade eletrônica.
As setas vermelhas indicam as ligações dativas e os traços indicam o compartilhamento de elétrons. Na ligação dativa, o átomo de enxofre “doa” um par de elétrons para cada átomo de oxigênio, estes, por sua vez, atingem a estabilidade eletrônica.
24ª semana
ligação metálica?O que é ligação metálica? Trata-se da forma como os átomos de um elemento metálico interagem entre si, o que origina diversas propriedades importantes, como a maleabilidade e a ductibilidade.

O metal ouro é constituído a partir de ligações metálicas
Os metais são elementos químicos que apresentam como principal característica física a capacidade de perder elétrons e, consequentemente, formar cátions metálicos. Por essa razão, eles podem realizar dois tipos de ligações químicas: a ligação iônica e a ligação metálica.A ligação iônica ocorre quando um metal interage com um elemento de natureza ametálica, que pode ser um ametal ou o hidrogênio. Nesse tipo de ligação, temos a perda de elétrons por parte dos metais e o ganho de elétrons por parte dos ametais ou do hidrogênio.Já a ligação metálica é estabelecida entre os átomos de um único elemento metálico. Esse tipo de ligação ocorre apenas entre os átomos de um único metal e exclusivamente porque um metal não pode estabelecer ligação química com outro elemento metálico diferente.Características gerais dos metais
- Sólidos em temperatura ambiente, com exceção do mercúrio
- São brilhantes;
- Apresentam elevados pontos de fusão e de ebulição;
- Apresentam, em geral, cor prateada, com exceção do ouro, que é dourado, e do cobre, que é avermelhado;
- Os metais puros são formados por aglomerados de átomos (de um único elemento químico) denominados de retículos cristalinos.
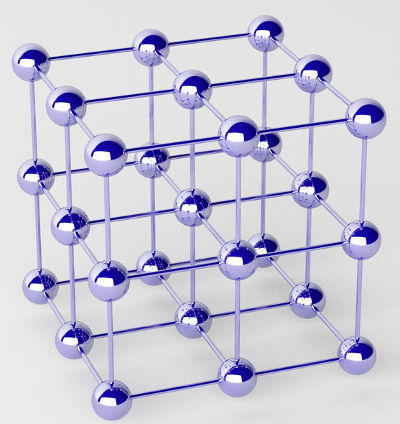
Representação do retículo cristalino de um metalPrincípios da ligação metálicaNa ligação metálica, os retículos cristalinos que formam os metais são, na verdade, um aglomerado iônico (composto apenas por cátions e elétrons). Os elétrons presentes na camada de valência dos átomos do metal são deslocalizados, ou seja, saem da camada de valência, fazendo com que o átomo se torne um cátion (deficiente em elétrons).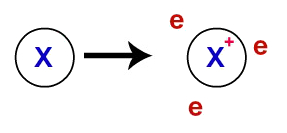
Representação dos elétrons deslocalizados da camada de valênciaApós serem deslocalizados, os elétrons provenientes dos átomos do metal passam a rodear os cátions, formando um verdadeiro “mar de elétrons”. Cada um dos elétrons presentes nesse mar possui capacidade de mover-se por meio do retículo cristalino do metal livremente.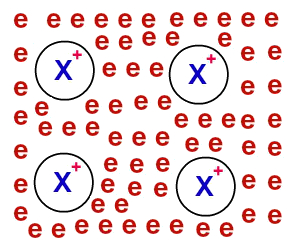
Representação do modelo do mar de elétronsOBS.: Os elétrons “do mar” não são capazes de abandonar o retículo cristalino e movimentam-se por ele.Propriedades dos metais justificadas pela ligação metálicaa) MaleabilidadePor meio de um metal, é possível produzir chapas de diversas espessuras e lâminas. É graças a essa propriedade dos metais que podemos construir diversos objetos, como facas, espadas etc.
A lâmina de uma espada é feita a partir de um metalb) CondutibilidadeOs metais, de uma forma geral, são bons condutores de corrente elétrica e calor. Quando um metal qualquer está em contato com uma fonte de calor ou com uma fonte de corrente elétrica, ele é capaz de conduzi-los.
Uma panela de alumínio na chama de um fogão fica inteiramente quente em virtude da condutividadec) DuctibilidadePor meio de um metal, podemos produzir fios. A utilização de um metal na forma de fios facilita a sua utilização, principalmente em relação à condutibilidade elétrica.
Um metal, como o cobre, pode ser utilizado para a produção de fios
Ligação Metálica

As propriedades de uma ligação são diferentes das propriedades dos seus elementos constituintes. Os metais quando analisados separadamente possuem características únicas que os diferem das demais substâncias: eles são sólidos à temperatura ambiente (25°C) e apresentam cor prateada.
A estrutura atômica dos metais é a Cristalina, que se constitui por cátions do metal envolvidos por uma nuvem de elétrons.
A capacidade que os metais têm de conduzir eletricidade se explica pela presença dessa nuvem de elétrons, que conduz corrente elétrica nos fios de eletricidade, não só neles, mas em qualquer objeto metálico.
As ligas metálicas possuem algumas particularidades que os metais puros não apresentam. Justamente por isso, são produzidas e utilizadas em abundância.
Vejamos as propriedades das ligações metálicas Aumento da dureza: se pegarmos, por exemplo, o elemento Ouro (Au) da forma como é encontrado na natureza não conseguiríamos fabricar nenhum objeto consistente, pois ele é mais maleável que a grande maioria dos metais.
Mas se adicionarmos a ele a prata (Ag) e o cobre (Cu) formaremos uma ligação metálica, aumentando a dureza e permitindo sua utilização para fabricar joias, como anéis, pulseiras, relógios, etc.
Essa liga metálica é também conhecida por Ouro 18 quilates e apresenta 75% em massa de ouro e os outros 25% correspondem à prata e ao cobre.Aumento da resistência mecânica: para fabricar materiais que tenham maior resistência ao manuseio, é preciso recorrer à ligação entre os metais.
O aço, por exemplo, é formado por ferro (Fe) e carbono (C).
Essa liga fica tão resistente que é usada na fabricação de peças metálicas que sofrem tração elevada.
Exemplos:Aço cirúrgico: é usado para a obtenção de instrumentos cirúrgicos, por apresentar alta resistência à oxidação.Aço inox: é uma liga dos metais ferro (Fe), carbono (C), cromo (Cr) e níquel (Ni); é usada para fabricar talheres para cozinha, peças de carro, etc.