As transformações químicas ocorrem todo o tempo ao nosso redor, por exemplo é muito comum notarmos que materiais metálicos como cercas, portões, pregos, entre outros ao ficarem expostos ao ambiente acabam se deteriorando. E isso ocorre devido ao contato do elemento químico ferro (Fe) com átomos de oxigênio (O) presentes no ar atmosférico e na água. Podemos notar também que em regiões litorâneas esses materiais sofrem ainda mais danos devido a presença de sais e uma maior umidade.
Esse fenômeno é conhecido como ferrugem e ocorre devido à uma reação de oxirredução. Mas o que é uma reação de oxirredução? Este tipo de reação ocorre quando entre os átomos envolvidos há transferência de elétrons. E neste caso a substância que recebe elétrons se reduz e por consequência é o agente oxidante; e quem perde elétrons se oxida e é o agente redutor. E devemos lembrar sempre que um processo não ocorre sem o outro, ou seja, são dependentes.

No caso da ferrugem quem oxida (agente redutor) é o ferro e isso
- Fe(s) → Fe2+ + 2e– (oxidação do ferro)
- O2 + 2H2O + 4e– → 4OH– (redução do oxigênio)
- + O2 + 2H2O → 2Fe(OH)2 (equação geral)
Na primeira reação temos a oxidação do ferro, depois a redução do oxigênio. Em seguida é mostrada a equação ou reação global.
Porém há formas muito práticas de evitar que materiais de ferro sejam agredidos, uma delas é impossibilitar o contato da água e do ar com o metal através da impermeabilização através de tinta ou óleo.
Outro meio destinado a proteção do ferro contra os “agentes enferrujantes” e que é muito utilizada na indústria em geral é a galvanização. Este processo consiste na adição de camadas protetoras de metais em geral, não somente o ferro, para proteção e para fins estéticos. A galvanização pode ser dividida em: cromagem (adição de camada de cromo), douração (adição de camada de ouro), zincagem (adição de camada de zinco), entre outros.
Eletrólise Aquosa
É uma eletrólise onde há a dissociação de um composto iônico em solução aquosa. O eletrodo deve ser inerte.
É necessário considerar a reação de autoionização da água, onde são produzidos íon H+ e íon OH-. O composto iônico é dissolvido em água, ocorrendo a formação de íons livres, que produzirão a corrente elétrica. Devem ser montadas as quatro reações para obter a reação global desta eletrólise.

Nesta cuba eletrolítica, deve haver água e o composto iônico dissolvidos. Da autoionização da água, serão formados íons H+ e íons OH-.
Se o composto for um sal, o NaCl, em contato com a água, formará o íon Na+ e o íon Cl-. Os íons positivos serão atraídos pelo eletrodo negativo e os íons negativos serão atraídos pelo eletrodo positivo. Cada par de íons (positivo e negativo) competirão entre si para ver qual se formará ao redor do seu respectivo eletrodo.
Existe uma tabela de facilidade de descarga elétrica, entre cátions e ânions:
Cátions:
Alcalinos
Alcalinos Terrosos
Al3+ < H+ < demais cátions
Ordem crescente de facilidade de descarga dos cátions
Ânions:
Ânions Oxigenados < OH- < ânions não oxigenados < halogênios
Ordem crescente de facilidade de descarga dos ânions
Observando a tabela, deve-se comparar então os seguintes íons:
– Cl- e OH-
– H+ e Na+
De acordo com a tabela, o íon Cl- (halogênio) tem mais facilidade do que o íon OH-.
De acordo com a tabela, o íon H+ tem mais facilidade do que o íon Na+.
Então, formam-se nos eletrodos, o gás hidrogênio (H2) e o gás cloro (Cl2).
No polo (-) = H+
No polo (+) = Cl-
Reações:

Observe que são formados o H2 e Cl2.
Também forma 2Na+ e 2OH-. Juntando estes dois íons, forma-se 2NaOH.

Resumo de pilhas e eletrólise
|
Pilha de Daniell |
Polo + |
Polo – |
|
Cátodo |
Ânodo |
|
|
Redução |
Oxidação |
|
|
Aumenta a lâmina |
Corrói a lâmina |
|
|
Dilui concentração |
Aumenta concentração |
|
|
Eletrólise |
Ânodo |
Cátodo |
|
Oxidação |
Redução |
A ferrugem é o resultado da oxidação do ferro. Sua principal causa é a exposição prolongada à água, pois os metais que contêm ferro se ligarão aos átomos de oxigênio da água, formando uma camada de óxido de ferro (ferrugem). O problema aumentará e acelerará a corrosão do metal, o que torna os cuidados de manutenção ainda mais importantes. Por sorte, remover a ferrugem não é muito difícil; basta utilizar algum dos métodos abaixo.
1 Faça uma solução de eletrólitos. Antes de mais nada, saiba que o método abaixo é muito mais fácil do que parece. Encha um balde de plástico com água o suficiente para submergir o objeto enferrujado. Acrescente uma colher de sopa de bicarbonato de sódio para cada três litros de água e misture bem até dissolver.
2 Use um pedaço descartável de aço como ânodo. O processo de eletrólise removerá a ferrugem do objeto que deseja limpar, e ela se fixará no outro metal submerso na água. O ideal é que o pedaço descartável seja grande o suficiente para ficar apenas meio submerso na água. É muito importante que metade dele fique para fora da água.
3 Conecte o terminal negativo (preto) de um carregador de bateria automotiva em uma seção sem ferrugem do objeto enferrujado. Se o objeto estiver completamente coberto pela ferrugem, raspe-a um pouco. Submerja o item na água, tomando cuidado para manter o cabo o mais fora da água possível.
- Atenção: o objeto enferrujado não deve entrar em contato com o ânodo, pois isso pode causar um curto-circuito.
4
Conecte o terminal positivo (vermelho) de um carregador de bateria automotiva no ânodo de metal. Lembre-se de não submergir completamente o objeto, ou você corre o risco de cortar a energia do terminal positivo.
- Se o ânodo ficar completamente submerso, use um arame ou algum outro conector entre ele o carregador de bateria para manter o terminal e a conexão seco
5 Conecte os terminais no carregador de bateria automotiva e ligue-o. O processo de eletrólise começará a remover gradualmente a ferrugem. Deixe agir por cerca de 20 horas.
- Atenção: se quiser checar o estado do objeto enferrujado, desligue e desconecte o carregador de bateria primeiro. Durante o processo, bolhas e sujeiras se acumularão na superfície, o que é absolutamente normal.
6 Desligue o carregador de bateria e desconecte os terminais dos objetos.Quando tirar o objeto enferrujado da água, ele estará limpo, mas ainda precisará de uma limpeza. Use uma buchinha de louça para remover os resíduos e uma escovinha de cerdas para limpar as áreas mais sujas.
A parte negativa vai no material que está com a ferrugem a positiva vai para o material de sacrifico
- Não utilize aço inoxidável ou alumínio como ânodo. Se você não sabe se o objeto que está utilizando é de aço ou não, veja se ele atrai um imã.
Eletrólise de solução aquosa de CuSO4, com eletrodos inertes
Eletrolise de solução aquosa de CuSO4, com eletrodos inertes
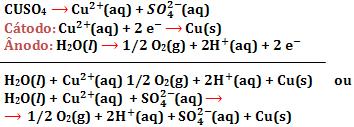
Postado em .
+ Artigos relacionados


