Separação de Materiais
SITUAÇÃO DE APRENDIZAGEM 5 COMO RECONHECER QUE HOUVE UMA TRANSFORMAÇÃO QUÍMICA?
Introdução:
Uma atividade que realizamos com frequência é separar. Assim, um caixa de banco separa notas de valores diferentes, uma granja seleciona ovos de tamanhos diversos, etc. Nesses casos, a técnica consiste numa “escolha ou catação”. Entretanto, nem sempre o processo é tão simples, embora trabalhoso. Por exemplo, como separar indivíduos mentirosos de não mentirosos?
Em Ciências, frequentemente, também há necessidade de separar materiais e as técnicas empregadas dependem dos tipos de materiais que serão separados.
No presente conjunto de experimentos procuramos desenvolver várias técnicas de separação de materiais (filtração em papel-filtro, adsorção por carvão ativo, evaporação, destilação, etc.), indicando inclusive se o processo é adequado ou não a um tipo de mistura, além de explicações sobre o mecanismo de cada processo.
Objetivos:
Familiarizar os alunos com várias técnicas de separação dos constituintes de diferentes misturas. Adquirir habilidade manual na execução dessas técnicas.
Propriedades da matéria:
As propriedades da matéria auxiliam na identificação e separação de uma substância e podem ser: físicas, funcionais, químicas, organolépticas, entre outras.
Propriedades específicas: Como o próprio nome indica, são aquelas específicas para cada matéria, que podem ser usadas para identificar a substância ou o composto que está sendo analisado.
Atividade 1 – Pode-se identificar uma substância por suas temperaturas de ebulição e de fusão?
Atividade 2 – Densidade: pode-se identificar uma substância por sua densidade?
Atividade 3 – Solubilidade: pode-se identificar uma substância por sua solubilidade?
Parte 1 Destilação:
Material
10 cm3 de solução de azul-de-metileno
cubo de gelo
2 tubos de ensaio (15 mm x 150 mm)
1 rolha de borracha (#16) com 1 furo de 4 mm de diâmetro
1 tubo flexível de plástico (50 cm de comprimento e 4 mm de diâmetro externo)
1 copo de vidro
1 suporte vertical metálico com base pesada
1 presilha
1 pinça metálica com cabo para prender o tubo de ensaio
1 funil de plástico (7 cm de diâmetro)
1 bastão de vidro (18 cm x 0,5 cm)
1 estante para tubos de ensaio
3 cacos de porcelana (pedrinhas de ebulição)
1 lamparina a álcool
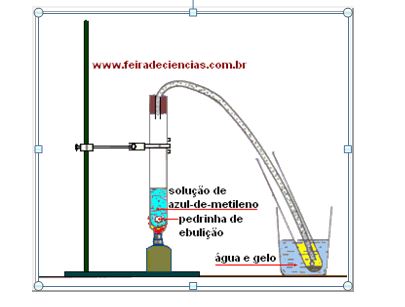
Procedimento:
a. Introduza o tubo de plástico na rolha, ultrapassando-a aproximadamente 1 cm.
b. Coloque o tubo de ensaio na estante, passe a solução de azul-de-metileno para o copo e, deste, para o tubo de ensaio, usando a técnica já descrita. O líquido não deverá ultrapassar 1/3 da altura do tubo.
c. Acrescente ao tubo as pedrinhas de ebulição.
d. Monte o conjunto indicado na ilustração acima.
e. Aqueça cuidadosamente e observe o que acontece nos dois tubos de ensaio.
f. Quando o líquido azul no tubo de ensaio da esquerda estiver reduzido à metade ou menos, retire a extremidade do tubo de plástico de dentro do tubo de ensaio da direita e, só então, apague a lamparina.
Observação
Se a lamparina for apagada antes de se retirar o tubo plástico do tubo de ensaio onde está o líquido destilado, este será sugado de volta para o tubo da esquerda (refluxo).
Resultado Esperado
A mistura entra em ebulição. Os vapores formados percorrem o tubo de plástico e, ao atingirem uma região mais fria, condensam-se. O líquido condensado é incolor, diferente, portanto,da solução inicial.
Parte 2 – A destilação e a separação de líquidos
Objetivo
Compreender que a destilação pode ser usada para separar líquidos que tenham pontos de ebulição diferentes.
Material
10 ml de álcool em frasco de vidro com tampa de rosca
1 béquer (100 ml)
1 tubo de ensaio (15 mm x 150 mm)
1 termômetro (de -10°C a +110°C)
1 funil de plástico (7 cm de diâmetro)
1 estante para tubos de ensaio
1 lamparina a álcool
1 tripé (10 cm de altura x 8 cm de lado)
1 tela de amianto (10 cm de lado)
Álcool para queimar
Procedimento
a. Coloque o tubo de ensaio na estante e a haste do funil dentro do tubo de ensaio. Ao lado da estante, coloque o frasco com 10 ml de álcool tampado.
b. Sobre a mesma mesa, mas afastada do frasco com álcool, coloque a lamparina e o tripé com a tela.
c. Sobre a tela, coloque o béquer com água até a metade e o termômetro, como indica a ilustração (a).
d. Acenda a lamparina e aqueça a água até a ebulição. Observe a temperatura da água e anote a temperatura em que ela entra em ebulição.
Observação
Para ler a temperatura, erga um pouco o termômetro de modo a mantê-lo no meio do líquido e não encostado ao fundo do recipiente. Movimente-o cuidadosamente para misturar o líquido, uniformizando assim a temperatura.
- Apague o fogo, retire a lamparina e, somente depois disso, coloque o álcool no tubo de ensaio, rapidamente, através do funil. Retire o funil.
f.Retire o termômetro do béquer, enxugue-o rapidamente e mergulhe-o no tubo de ensaio com álcool.
g. Coloque o conjunto tubo-termômetro na água que acabou de ser aquecida, agite o tubo dentro da água e observe o que acontece com o álcool. Anote a temperatura indicada pelo termômetro; siga ilustração (b).
Resultados Esperados e Discussão
- A água ferve a 100°C ou um pouco abaixo dessa temperatura, dependendo da altitude do local e do grau de pureza da água.
- É possível que os diferentes grupos encontrem temperaturas diferentes para a ebulição da água. Isto pode ser explicado em termos de ligeiras diferenças entre os termômetros, imperfeições nas leituras feitas, transferência do calor das mãos para o termômetro, etc.
- O álcool, por sua vez, ferve a 78°C ao nível do mar, desde que seja puro. Os alunos deverão encontrar temperatura em torno desse valor, de acordo com as razões já expostas para a água.
- A destilação pode ser empregada para separar misturas quando as substâncias que dela fazem parte tenham, como a água e o álcool, pontos de ebulição convenientemente afastados. No caso particular da mistura álcool-água, o destilado ainda contém pequena porcentagem de água (mistura azeotrópica).
- Se o experimento da Parte 5 – destilação – fosse realizado utilizando-se, no tubo da esquerda, uma solução de água e álcool, a ebulição teria início aproximadamente a 78°C.
Situação de aprendizagem 4
A PRODUÇÃO DO ÁLCOOL COMBUSTÍVEL
Nesta Situação de Aprendizagem, ampliaremos os conhecimentos sobre as transformações químicas, abordando dois importantes processos industriais – a fermentação alcoólica que levam à obtenção, respectivamente, do etanol Para isso, leia os textos a seguir.
Leitura e análise de texto
Texto 1 – Fermentação alcoólica na produção do etanol
O Brasil é um dos poucos países do mundo que utilizam álcool (etanol) como combustível automotivo. Esse fato garante ao país não apenas a posição de um dos maiores produtores de etanol do mundo, mas também de detentor da melhor tecnologia de produção de álcool a partir da cana-de-açúcar. Mas você sabe como é produzido o álcool a partir da cana-de-açúcar? A cana-de-açúcar é a principal matéria-prima usada na produção de álcool no Brasil. A
partir de 1 ha (um hectare, ou seja, 10 000 m2) de plantação, pode-se obter cerca de 3 mil litros de etanol. A cana-de-açúcar passa inicialmente pelo processo de moagem, em que o suco da cana, a garapa, é separado do bagaço, que pode ser queimado como combustível ou usado na alimentação do gado. Em seguida, a garapa é aquecida até que boa parte da água evapore e se forme um líquido viscoso e rico em açúcares, chamado melaço. Esse material é acidificado para que esteja em condições ideais para o desenvolvimento das leveduras (micro-organismos que possuem substâncias denominadas enzimas, capazes de acelerar a transformação de açúcares em álcool etílico e gás carbônico). É na presença das leveduras que o melaço passará pelo processo de fermentação alcoólica, que dura cerca de 50 horas, ocorrendo a formação do etanol.
A mistura obtida na fermentação apresenta cerca de 14% em volume de álcool, mas, após o processo de destilação, obtém-se álcool com 96° GL (4% de água e 96% de etanol). Para obter etanol puro (100%) pode-se adicionar cal viva ao álcool 96° GL. Nesse caso, haverá interação entre a cal e a água, formando um composto pouco solúvel em água e em etanol, o hidróxido de cálcio ou cal extinta, conforme as representações a seguir:
sacarose + água glicose + frutose
C12H22O11(aq) + H2O(l) àC6H12O6(aq) + C6H12O6(aq)
glicose ou frutose etanol + gás carbônico + energia
C6H12O6(aq) 2 à C2H5OH(aq) + 2 CO2(g) + energia térmica
óxido de cálcio + água A hidróxido de cálcio + energia
CaO(s) + H2O(l) à Ca(OH)2(s) + energia térmica
Embora tenhamos tratado aqui da produção do álcool a partir da cana-de-açúcar, essa não é a única matéria-prima da qual se pode obtê-lo. Além disso, o uso do álcool etanol não se restringe ao mercado de combustíveis, pois ele apresenta inúmeras outras aplicações na indústria e no dia a dia.
Objetivo
Compreender que a destilação pode ser usada para separar líquidos que tenham pontos de ebulição diferentes.
Resultados Esperados e Discussão
- A água ferve a 100°C ou um pouco abaixo dessa temperatura, dependendo da altitude do local e do grau de pureza da água.
- O álcool, por sua vez, ferve a 78°C ao nível do mar, desde que seja puro. Os alunos deverão encontrar temperatura em torno desse valor, de acordo com as razões já expostas para a água.
- A destilação pode ser empregada para separar misturas quando as substâncias que dela fazem parte tenham, como a água e o álcool, pontos de ebulição convenientemente afastados.
Extração por solvente:
INTRODUÇÃO:
Qualquer vegetal que possua óleos voláteis aromatizados pode ser utilizado como matéria-prima para a extração de óleos essenciais. A técnica de destilação por arraste.
Óleos essenciais são compostos aromáticos, voláteis que podem ser extraídos de raízes, caules, folhas, flores ou todas as partes de plantas aromáticas.
Essas extrações podem ser realizadas através de destilação por arraste a vapor, compressão de vegetais ou uso de solventes. Esses óleos apresentam estruturas diversas como ácidos carboxílicos, alcoóis, fenóis, aldeídos, cetonas, ésteres, hidrocarbonetos, dentre outras, cada qual com sua característica aromática e ação bioquímica. Os óleos essenciais possuem grande importância industrial e são utilizados nas indústrias de perfumaria, cosméticos, alimentos e farmacêutica.
O solvente é colocado em um balão de fundo redondo que é aquecido em uma manta aquecedora até a ebulição. O vapor do solvente sobe, sendo resfriado no condensador de bolas ou tipo serpentina, e passa para a região do extrator, onde está a amostra da matéria-prima em um papel de filtro. Assim, o solvente extrai os componentes aromáticos, enchendo cada vez mais essa vidraria. Quando ela enche por completo, o solvente com a essência cai novamente para o balão e o processo continua quantas vezes forem necessárias, extraindo cada vez mais compostos aromáticos.
Determinação do teor de álcool na gasolina
Para lucrar em cima dos proprietários de automóveis, alguns adicionam álcool na gasolina
No texto “Adulteração de gasolina e suas consequências”, foi salientado que muitos donos de postos de combustíveis e de distribuidoras fazem adulterações na gasolina, misturando-a com outros solventes mais baratos, com a finalidade de lucrar em cima do prejuízo dos proprietários dos veículos.
Um dos solventes utilizados com frequência é o etanol (álcool). Segundo a Agência Nacional de Petróleo, Gás Natural e Biocombustíveis (ANP), a porcentagem obrigatória de etanol anidro combustível que deve ser adicionado na gasolina é de 25%, sendo que a margem de erro é de 1% para mais ou para menos.
Isso é feito porque o etanol funciona como um antidetonante da gasolina nessas proporções, ou seja, ele aumenta o seu índice de octanagem, resistindo a maiores compressões, porque o poder calorífico do etanol é menor. Além disso, a gasolina com etanol libera menos monóxido de carbono para o meio ambiente.
No entanto, a adição de etanol à gasolina acima do limite traz danos ao veículo, por exemplo, o carro começa a falhar, sendo preciso dar a partida várias vezes para voltar a funcionar, as peças do sistema de injeção eletrônica são corroídas, além dos outros problemas mostrados no texto que foi mencionado acima.
Para saber se você está sendo enganado ou não, existe um teste bastante simples que pode ser realizado, chamado de “teste da proveta”.
Materiais Necessários:
- Uma proveta de 100 mL, limpa, seca, desengordurada e com tampa;
- 50 mL da gasolina que se deseja analisar;
- 50 mL de solução de cloreto de sódio (NaCl) na concentração de 10% p/v, isto é, 100g de sal para cada 1 litro de água (muitas vezes, utiliza-se apenas água, mas o indicado pela ANP é com a solução aquosa de cloreto de sódio).
Procedimentos:
- colocar 50 mL de gasolina na proveta e, em seguida, adicionar 50 mL da solução de cloreto de sódio.
- Com a boca tampada, misture a gasolina e a solução, mas não agite. Faça isso invertendo a proveta por 10 vezes sucessivas. Deixe em repouso por 15 minutos.
- Observar que a água irá retirar o álcool que estava misturado na gasolina.
Isso acontece porque o etanol possui uma parte polar e outra apolar, sendo que sua parte apolar é atraída pelas moléculas da gasolina que também são apolares pela força de dipolo induzido. Mas, a sua parte polar, caracterizada pela presença do grupo OH é atraída pelas moléculas de água, que também são polares, realizando ligações de hidrogênio que são bem mais fortes que as ligações do tipo dipolo induzido.
Como a água é mais densa, ela ficará na parte inferior e a gasolina na parte superior.
- Para sabermos então se a quantidade de etanol que tinha na gasolina estava dentro dos parâmetros estabelecidos por lei, basta ver quanto de álcool foi retirado dela. Por exemplo, digamos que depois que as camadas se separaram, o volume da fase aquosa passou de 50 mL para 60 mL e a da gasolina ficou 40 mL. Então teremos que 10 mL de álcool foram extraídos da gasolina. Baseado nisso, faz-se a seguinte regra de três para saber quanto isso representa em porcentagem:
50 mL — 100%
10 mL—– x
50 . x = 10 . 100%
x = 1000%/50
x = 20%
Essa gasolina não está dentro dos limites.
Você poderá também usar diretamente a seguinte expressão matemática:
% álcool = Volume do álcool na gasolina . 100%
Volume inicial da gasolina
Densidade
É uma grandeza que relaciona a massa (m) de um material com o volume (V) por ele ocupado e pode ser expressa pela divisão abaixo:
densidade = massa ou d = m
volume V
Se um material possuir densidade menor que outro, ele irá flutuar sobre ele. O contrário também ocorre, quando o material tem densidade maior, ele afunda.
Para testar isso, vamos fazer uma experiência bem simples. Você vai precisar de:
- 3 ovos crus (você também pode usar o mesmo ovo se quiser);
- 3 copos de vidro;
- Sal;
- Colher;
- Água;
Procedimentos:
- Usando a caneta e as etiquetas, identifique os dois copos, colocando os seguintes dizeres em cada um: “água sem sal”, “água com sal” e “mistura”;
- Coloque água no primeiro copo;
- Coloque o ovo e observe se ele afunda ou flutua;
- Coloque a mesma quantidade de água no segundo copo;
- Adicione sal e misture bem;
- Acrescente o ovo e observe se dessa vez ele afunda ou flutua;
- Agora, você irá colocar no terceiro copo partes iguais da água sem sal e da água com sal;
- Adicione o ovo cru e visualize onde ele se posicionará;
9- Adicione mais água doce e veja o que acontece;
10- Adicione mais água salgada e observe.
Explicação:
O ovo cru afundou no primeiro caso porque a sua densidade é maior que a da água. No momento em que acrescentamos sal na água, aumentamos a sua densidade e, dessa forma, o ovo flutua, pois sua densidade passou a ser menor que a da mistura de água e sal. Quando mais sal colocarmos, mais a densidade da água aumentará.
Isso pode ser visualizado no caso do mar Morto, em Israel, o corpo de água mais salgado do planeta (30% de salinidade). Em virtude disso, ele não consegue sustentar vida. Quando pessoas tomam banho no mar Morto, elas podem flutuar facilmente, como mostra a figura abaixo:
Mulher flutua facilmente em mar Morto
Os sais que ele contém são basicamente cloretos de magnésio, de sódio e de cálcio, que são levados até ele pelo rio Jordão e por outros rios, riachos e fontes menores.
Só o rio Jordão deposita nele cerca de 850 mil toneladas de sal todo ano!Além disso, como ele se situa em uma região de baixa altitude, ele não escoa para nenhum lugar, apenas evapora, e os sais permanecem. Em um dia quente, pode acontecer de7 milhões de toneladas de água evaporarem e, por isso, ele é o mar mais salgado que existe.
Sal do mar Morto na mão de uma pessoa
Agora, quando dosamos cuidadosamente a mistura da água com e sem sal, conseguimos produzir um líquido de densidade exatamente igual à do ovo, por isso ele não afunda nem flutua, mas permanece em suspensão no meio do líquido.
Dica:
Você pode usar esse experimento para verificar se o ovo está próprio para o consumo ou se está estragado. Se o ovo afundar, significa que você pode consumi-lo, está fresco. Isso acontece porque assim que é posto, ele preenche quase todo o volume no interior da casca e tem apenas uma pequena bolsa de ar.
No entanto, com o passar do tempo, o ovo vai perdendo água de seu interior pelos poros da casca e fica menos denso. Dentro de cerca de uma ou duas semanas, ele flutua o suficiente para se manter na vertical, no fundo do copo com água, mas ainda pode ser usado.
Mas quanto mais o tempo passa, mais a bolsa de ar vai crescendo e menos denso o ovo fica. Portanto, se ele flutua na superfície da água pura, ele não deve ser usado, pois pode causar uma intoxicação alimentar grave.
Experiência: água, óleo e detergente. Polaridade das moléculas
Por que o detergente ele “joga nos dois times”: uma parte de sua molécula é polar, portanto interage com a água; e a outra parte é apolar, que interage com a água. Quando se faz a mistura óleo + água + detergente, começa a ocorrer a formação de micelas, que nada mais são do que gotículas de gordura, interagindo com a parte apolar da molecula do detergente.
SOLUÇÕES
Conceito
Determinado material é denominado solução quando é uma mistura homogênea de duas ou mais substâncias.
São exemplos de soluções a água do mar, o bronze, o latão, o aço, etc. Numa solução, a substância dissolvida denomina-se soluto e aquela em que este (ou estes) se dissolvem denomina-se solvente.
Considere duas soluções: água-sal de cozinha e água-álcool.
Quando se adiciona uma pequena quantidade de sal de cozinha a um copo com água, o sal se dissolve, formando uma solução diluída.
Aumentando-se a quantidade de sal, a solução vai-se tornando cada vez mais concentrada, até saturar-se, isto é, até atingir a capacidade máxima de dissolução.
A partir desse ponto, todo sal adicionado deposita-se no fundo, não se dissolvendo. Portanto, por mais sal que se adicione, a concentração da solução permanece constante (desde que a temperatura também não se altere).
Soluções nessas condições são denominadas saturadas.
Neste exemplo, a água é o solvente e o sal é o soluto.
Considere agora soluções de álcool e água. Estas jamais atingem a saturação: os dois líquidos são miscíveis, independentemente da quantidade relativa de cada um. Neste caso, qual o soluto? Qual o solvente?
As respostas requerem bom-senso: numa solução onde a quantidade de água excede a de álcool, diz:se que o solvente é a água; no caso inverso, o solvente seria o álcool.
E quando ambos existem em quantidades iguais? Neste caso, tem-se liberdade de escolher e qualquer resposta será válida.
Quando dizemos que uma solução é diluída ou concentrada, estamos expressando a concentração de modo vago, meramente qualitativo.
Entretanto, para muitos experimentos, precisamos utilizar soluções com concentração bem definida, expressa quantitativamente essas quantidades podem ser expressas em mol, massa ou volume. E aí podem ser feitas as diversas combinações entre mol, massa e volume para obter uma relação de concentração.
Soluções Molares
Damos o nome de soluções molares a soluções cuja concentração é expressa em função da massa molecular do soluto. Assim, dizemos que determinada solução é 1 molar (1 M) quando contém 1 mol de soluto em 1 litro de solução. Uma solução 0,2 molar (0,2 M) contém 0,2 mol de soluto em um litro de solução.
Para preparar soluções molares de uma substância, precisamos, antes de mais nada, saber quanto vale 1 mol dessa substância.
Vejamos dois exemplos:
- Preparação de solução 1,0 M de NaCI. Consultando-se uma tabela de massas atômicas, encontramos:
Massa atômica do sódio = 23,0
Massa atômica do cloro = 35,5
1 mol de NaCI = 23,0 g + 35,5 g = 58,5 g
Portanto, deve-se dissolver 58,5 g de NaCI em pequena quantidade de água e completar até 1 L. - Preparação de solução 0,2 M de NaCI.
1,0 mol de NaCI = 58,5 g de NaCI
0,2 mol de NaCI = x g de NaCI
Donde: x = (0,2 x 58,5) g de NaCI = 11,7 g ≈ 12 g
Então, para preparar a solução 0,2 M de NaCI pesam-se 12 g de NaCI, dissolvem-se em pequena quantidade de água e completa-se o volume até obter um litro.
É muito frequente utilizarmos quantidades pequenas de solução, não havendo necessidade de preparar um litro. Se, por exemplo, forem necessários apenas 50 ml de solução 0,2 M de NaCI, procede-se da seguinte maneira:
- Calcula-se quantos gramas representam 0,2 mol dessa substância (12 g; veja acima).
- Calcula-se, em seguida, a massa de NaCI necessária para 50 ml de solução:
- Para 1000 ml de solução são necessários 12 g de NaCI.
Para 50 ml de solução são necessários x g de NaCI.
Portanto: x = (50×12)/1000 = 0,6 g.
Exercícios:
- Quantos gramas de nitrato de chumbo, Pb (N03)2, são necessários para preparar 400 ml de solução 2,00 M dessa substância?
Resposta: 265 g. - Quantos gramas de hidróxido de sódio, NaOH, são necessários para preparar 50 ml de solução 0,80 M dessa substância?
Resposta: 1,6 g.
Molaridade de Alguns Reagentes
Os ácidos clorídrico, nítrico e sulfúrico, e a amônia, vendidos no comércio como reagentes concentrados, são soluções aquosas, cujas molaridades são aproximadamente as seguintes:
| Substâncias | Molaridades |
| HCl | 11,7 |
| HNO3 | 15,6 |
| H2SO4 | 18,0 |
| NH3 | 15,1 |
Portanto, para preparar, por exemplo, um litro de solução 1 molar (1 M) de ácido clorídrico, deve-se diluir 11,7 vezes o ácido concentrado. Em outras palavras, a solução 1M de ácido clorídrico é 11,7 vezes menos concentrada do que a solução comercial.
Portanto, 1000 ml de solução 1M devem conter: 1000/11,7 = 85 ml de ácido concentrado, completando-se o volume com água, até obter-se 1 litro (1000 ml).
Soluções Molares de Sais Hidratados
Certos sais são normalmente fornecidos na forma hidratada, isto é, cada molécula do sal está associada a diversas moléculas de água. Por exemplo, os cristais azuis de sulfato de cobre são hidratados e devem ser representados pela fórmula CuS04. 5H20. Os cristais de sulfato de cobre anidro, CuS04, são brancos.
Para preparar uma solução molar de um sal hidratado, é necessário levar em consideração a quantidade de água já existente nos cristais, ou seja, é preciso conhecer a massa molecular do sal anidro e a do sal hidratado. Por exemplo:
Massa molecular do CuS04 anidro = 63,5 + 32 + 64 = 159,5
Massa molecular do CuSO4.5H2O = 159,5 + (5 x 18) = 249,5
Ora, existe a mesma quantidade de CuSO4, em 159,5 g do sal anidro e em 249,5 g do sal hidratado. Portanto, para preparar 1 litro de solução molar, deve-se usar 159,5 g do sal anidro ou então 249,5 g do sal penta-hidratado.
Observações:
- Desejando-se trabalhar com o sal anidro, deve-se secar os cristais em estufa ou sobre chama fraca. Em ambos os casos, os cristais devem ser colocados numa cápsula de porcelana.
- As soluções denominadas padronizadasou tituladas são soluções cuja concentração é conhecida com grande precisão. São preparadas de acordo com técnicas especiais descritas em textos de Química Analítica Quantitativa.
- Nos experimentos contidos neste PQE não há necessidade de soluções padronizadas.
Solução de Fenolftaleína
Dissolver 0,5 g de fenolftaleína (pó) em 100 ml de álcool a 96%.
Solução de Azul-de-Metileno
- Dissolver 0,5 g de azul-de-metileno (pó) em 30 ml de álcool a 96%.
- Dissolver 0,1 g de potassa cáustica (granulado) em 100 ml de água.
- Juntar as duas soluções.
Solução de Azul-de-Bromotinol
- Solução a 0,1 %: dissolver 0,5 g de azul-de-bromotinol em pó em 500 ml de água destilada.
- Solução a 0,04%: dissolver 0,4 g de azul-de-bromotinol em 1000 ml de água destilada.
Determinação da acidez em óleo vegetal
- ÍNDICE DE ACIDEZ
Os óleos vegetais comestíveis fazem parte da dieta da maioria dos povos, apresentando funções importantes no metabolismo humano. Eles representam fonte de energia para o corpo humano, além de conterem ácidos graxos essenciais, vitaminas e antioxidantes lipossolúveis, tais como os tocotrienóis e os tocoferóis.
O óleo de soja é o óleo de cozinha mais conhecido. Os chamados óleos vegetais são geralmente óleos de soja. A maior parte do óleo de soja é composto por gordura insaturada. Ácidos graxos poliinsaturados, monoinsaturados, e saturados correspondem, em média, a 61%, 25% e 15%, respectivamente. O ácido linolênico (componente da fração poliinsaturada do óleo), que corresponde, em média, a 7% da composição do óleo, é um ácido graxo ômega-3.
Uma boa máteria-prima e um processamento adequado leva a produção de óleo de soja de boa qualidade. Para o controle da qualidade do óleo de soja são realizadas algumas análises físico-químicas, tais como: determinação do Índice de Acidez, do Índice de Peróxido, de Fósforo, de Umidade, do Índice de Saponificação, entre outros.
Com base nessas informações é possível ajustar o processo de extração e refino de acordo com as características de qualidade estabelecidas para o produto e identificar se o produto está deteriorado ou inadequado para o consumo.
O índice de acidez corresponde à quantidade (em mg) de base (KOH ou NaOH) necessária para neutralizar os ácidos graxos livres presentes em 1 g de gordura.
A principal forma de deterioração dos óleos consiste na oxidação, que ocorre quando o oxigênio atmosférico é dissolvido no óleo e reage com os ácidos graxos insaturados, que são tanto mais reativos quanto maior número de insaturações em suas cadeias.
A oxidação lipídica é responsável pelo desenvolvimento de sabores e odores desagradáveis tornando os alimentos impróprios para o consumo, além de provocar outras alterações que irão afetar não só a qualidade nutricional, mas também a integridade e segurança do alimento, através da formação de compostos poliméricos potencialmente tóxicos.
Durante o processo de fritura, o alimento entra em contato com óleo em temperaturas entre 180 – 190°C que provocam uma série complexa de reações e a produção de numerosos compostos de degradação no óleo que são transmitidos aos alimentos.
Tais reações alteram a qualidade funcional, sensorial e nutricional dos alimentos, podendo atingir níveis em que não se consegue mais manter sua qualidade.
A complexidade do processo de fritura induz diferentes reações químicas, as quais resultam na formação de diversos produtos da decomposição de óleos e gorduras, portanto alteração nos valores dos índices determinados pelas análises físico-químicas.
Objetivo da aula é analisar as alterações físico-químicas do óleo de soja, utilizado em processos de fritura, através da determinação do seu índice de acidez.
ÍNDICE DE ACIDEZ
MATERIAIS
- Erlenmeyer
- Proveta
- Pipetas
- Bureta
- Béquer
- Balança semi-analitica
REGENTES
- Indicador: fenolftaleína 1% m álcool 95°GL
- 100 mL de solução de NaOH 0,1N
- Solução de álcool etílico 95°GL e éter etílico (1:2 v/v) neutralizada
AMOSTRA
- Óleo de soja refinado reutilizado várias vezes em fritura
PROCEDIMENTO
- Neutralização da solução de álcool etílico 95°GL e éter etílico (1:2 v/v): em um erlemeyer contendo 40mL da solução álcool-éter adicionou-se 0,3mL de fenolftaleína e gotejou-se a solução titulante de NaOH 0,1N até leve coloração rósea persistente.
- Em um erlenmeyer pesou-se 5,045g da amostra de óleo de fritura.
- Adicionou-se ao erlenmeyer contendo a amostra, a solução álcool-éter e 0,6 mL de fenolftaleína.
- Fez-se a titulação em cada erlenmeyer com NaOH 0,1N até o aparecimento de cor rósea persistente por 30 segundos.
- Anotou-se o volume de NaOH (mL) gasto na titulação.
RESULTADOS E DISCUSSÃO
ÍNDICES DE ACIDEZ
CÁLCULOS
Foram gastos 3,4mL de NaOH na titulação do óleo de soja reutilizado várias vezes em fritura.
Para o cálculo, em porcentagem, da acidez em soluto alcalino normal utiliza-se a seguinte fórmula:
Índice de Acidez (%) = ml de NaOH x 0,01N x 282
Massa de amostra (g)
Onde, o volume em mL de solução de NaOH gasto na titulação, N é a normalidade da solução de NaOH, e o fator de correção da solução de NaOH, é dividido pelo peso da amostra em gramas.
Então, na amostra de óleo de soja reutilizado em fritura temos:
Índice de acidez (%) = 3,4 x 0,01 x 282 = 1,9176
DISCUSSÃO
Sabe-se que o óleo de frituras, além de poluir o meio ambiente quando descartado incorretamente, também prejudica a nossa saúde se usado muitas vezes, pois libera toxinas. Os ácidos graxos são constituintes dos óleos e gorduras na forma de mono, di e triglicerídeos, uma grande quantidade de ácidos graxos livres indica que o produto está em acelerado grau de deterioração.
A principal consequência disso é que o produto torna-se mais ácido. Um elevado índice de acidez indica, portanto, que o óleo ou gordura está sofrendo quebras em sua cadeia, liberando seus constituintes principais: os ácidos graxos.
Os ácidos graxos livres são elementos indesejáveis que causam dependendo de sua origem cheiros e sabores indesejáveis. O conteúdo de ácidos graxos livres dos óleos brutos depende da sua qualidade. Em geral, o aumento da acidez declina a qualidade do óleo, e é por esse motivo que o cálculo desse índice é de extrema importância na avaliação do estado de deterioração (acidez hidrolítica) do óleo ou gordura que consumimos.
A ANVISA (1999) utiliza como parâmetro de qualidade o índice de acidez em porcentagem equivalente ao ácido oleico, sendo da mesma forma, o índice de acidez calculado nesta prática. Para a ANVISA (1999) o índice de acidez do óleo de soja refinado e para outros óleos vegetais, como: canola, milho, girassol, amendoim, em gramas de ácido oleico/100g de óleo é no máximo 0,3, ou seja, 0,3%. Comparando este valor com o obtido, para o óleo de soja reutilizado em fritura, o valor encontrado foi 1,9176%, conferindo também a este óleo a inadequação para o consumo, se compararmos ao valor encontrado no óleo virgem, ele é cerca de seis vezes maior do que o máximo permitido por lei. Não foi encontrado em legislação brasileira, o máximo de índice de acidez para um óleo que foi submetido a várias frituras ou a algum processamento, pois conforme se aumenta o número de frituras pode ocorrer maior hidrólise do óleo devido a alta temperatura e troca de umidade do alimento para o meio de fritura, com consequente aumento no conteúdo de ácidos graxos livres.
De acordo com o médico-cardiologista o ideal é radicalizar com a fritura e cortá-la do cardápio, mas sabe-se que nem sempre é possível. Portanto, de acordo com ele o óleo que é menos nocivo à saúde é o óleo de soja, em caso de utilizá-lo para fritura somente uma única vez, claro, é economicamente “salgado” para o bolso, se for batata pode ser utilizado duas vezes e totalmente desprezado logo após o uso. Lembrando que essa medida apenas ameniza os efeitos prejudiciais da famigerada FRITURA!!! Garantindo maior qualidade sobre o que se come, seguindo está recomendação o colesterol pode baixar mesmo comendo frituras.
DETERMINAÇÃO DA ACIDEZ DO VINAGRE.
- Introdução
Vinagre de vinho ou simplesmente vinagre é o produto obtido pela fermentação acética do vinho, apresentando uma acidez mínima de 4g/100mL do produto, expressa em ácido acético, sendo os outros componentes proporcionais à matéria-prima usada em sua elaboração. De acordo com a matéria-prima que lhe deu origem, o vinagre pode ser classificado como vinagre de vinho tinto ou branco.
Na fermentação do vinho o álcool etílico é oxidado pelo ar e forma-se ácido acético, do Latim acetum e a reação é catalisada por enzimas bacterianas, Acetobacter. Após fermentação, apresenta cerca de 4 a 5% de ácido acético, recebendo o nome de vinagre, vinho azedo. O ácido acético é um ácido fraco, apresentando Ka de 1,8×10-5. Ele é amplamente usado em Química Industrial na forma de ácido acético glacial (densidade de 1,053g/cm3 e 99,8%) ou em soluções de diferentes concentrações.
Fermentado acético é o produto resultante da fermentação de frutas, cereais, vegetais, mel ou da mistura de vegetais, devendo apresentar uma acidez volátil expressa em ácido acético de no mínimo 4g/100mL. O fermentado acético pode ter adição de condimentos, aromas, extratos vegetais e óleos essenciais.
As características de vinagres estão definidas nos padrões de identidade e qualidade estabelecidos pelo Ministério da Agricultura, Pecuária e Abastecimento.
Na análise destes produtos, as determinações usuais são, entre outras: extração preliminar, densidade relativa, acidez total, acidez volátil, acidez fixa, álcool em volume, pH, extrato seco, glicídeos redutores em glicose, sulfatos, extrato seco reduzido, cinzas, dióxido de enxofre e eventualmente corantes orgânicos artificiais e contaminantes orgânicos.
No laboratório, a análise da acidez é realizada através da titulação de neutralização utilizando solução NaOH 0,1mol/L padronizada e fenolftaleína 1% como indicador. O NaOH reage quantitativamente com o ácido acético presente no vinagre e após a reação total, um pequeno excesso de NaOH torna a solução alcalina e o indicador adquire uma coloração rosa.
Objetivos
Esta aula tem como objetivos determinar a concentração de ácido acético presente numa amostra de vinagre por volumetria de neutralização e verificar se o produto atende as especificações de qualidade, ou seja, se contém 4 a 5g de ácido acético em 100mL de vinagre.
MATERIAIS E REAGENTES
| · Funil de vidro | · Pipeta volumétrica de 10mL (2) |
| · Balão volumétrico de 250mL | · Erlenmeyer de 250mL |
| · Bureta de 50mL | · Proveta de 50mL |
| · Béquer de 50 ou 100mL | · Béquer com água destilada recém fervida |
| · Agitador magnético· Suporte e garra | · Barra magnética |
4. Reagentes
| · Fenolftaleína 1%· Vinagre tinto | · Solução padrão de NaOH 0,1mol/L· Vinagre branco |
5. Procedimento experimental
5.1. Preparação da solução de vinagre (uma solução por turma)
Homogeneíze a amostra de vinagre branco e pipete uma alíquota de 25mL para um balão volumétrico de 250mL. Complete o volume com água destilada e acerte o menisco. Agite para homogeneizar.
5.2. Determinação da acidez total no vinagre (por grupo)
Pipete uma alíquota de 25mL da solução de vinagre preparada anteriormente e transfira para um erlenmeyer de 250mL. Meça 40mL de água destilada numa proveta e adicione no erlenmeyer. Adicione 2 a 3 gotas de solução alcoólica de fenolftaleína e homogeneíze. Monte o sistema de agitação magnética.
Lave a bureta de 50mL com um pouco de NaOH 0,1mol/L. Descarte este volume. Fixe a bureta de 50mL no suporte universal. Feche a torneira de controle de escoamento. Com auxílio de um béquer de 50mL, encha a bureta com solução de NaOH 0,1mol/L e observe se há vazamento.
Verifique se há bolhas entre a torneira e a extremidade inferior da bureta. Caso tenha, abra a torneira rapidamente até removê-la. Em seguida, encha a bureta com NaOH 0,1mol/L e acerte o menisco com o traço de aferição (zero), que fica na parte superior.
Titule com a solução de NaOH 0,1mol/L até mudança de coloração para levemente rosa. Anote o volume e calcule o teor de ácido acético no vinagre em g/100 mL. Durante a adição do NaOH, o erlenmeyer contendo o vinagre dissolvido foi agitado circularmente com uma mão enquanto a outra controlava a torneira. A adição da base continuou até que aparecesse mudança de coloração na solução, assinalando o ponto final da titulação.
RESULTADOS E DISCUSSÃO
Cálculos e resultados referentes a análise do vinagre:
| N° de Repetições | Volume da Bureta |
| V3 | 25 mL |
| V4 | 24,9 mL |
Tirou-se a média dos valores obtidos, de acordo com o calculo abaixo:
V3 + V4 = 25 + 24,9 = 24,95
2 2
Retirada a media, calculou-se a concentração do acido acético no vinagre branco.
Logo:
N1 x V1 = N2 x V2
0,1 x 24,95 mL = N2 x 25 mL
N = 0,0998N (concentração do acido acético no vinagre branco)
Tabela 3 – Resultados obtidos da analise do vinagre tinto.
CONCLUSÃO
A solução de hidróxido de sódio foi padronizada, de acordo com a titrimetria de neutralização utilizando como padrão primário o sal biftalato de potássio, com a concentração de 0,1N.
A partir da analise titrimetrica realizada, pode-se concluir que o vinagre comercial submetido a tal contem uma concentração de acido acético dentro das especificações de qualidade
Preparação e padronização de solução NaOH 0,1 mol/L
- Introdução
A solubilidade de uma substância num determinado solvente é controlada principalmente pela natureza do próprio solvente e do soluto, mas também pela temperatura e pressão. Uma solução é formada quando uma mistura homogênea de duas ou mais substâncias formam uma única fase. O componente presente em maior quantidade é chamado solvente e os outros componentes são denominados solutos.
As propriedades das soluções, por exemplo, a cor ou o sabor depende de sua concentração. Em química, a quantidade de soluto dissolvido numa unidade de volume ou de massa da solução ou do solvente se denomina concentração. A concentração é expressa, comumente, em mol do soluto por litro da solução; esta concentração é a molaridade da solução.
Em análise química é necessário preparar soluções de concentração exatamente conhecida, isto é soluções padrões. Essas soluções requerem, muitas vezes, que se faça uma análise titulométrica para se determinar à quantidade exata do soluto presente no volume da solução. Este procedimento chama-se padronização da solução.
A solução padrão é usualmente adicionada por uma bureta. O processo de adição da solução padrão até que a reação esteja completa é chamado de titulação e a substância a ser determinada de titulada. O ponto final da titulação chama-se ponto de equivalência. Este final deve ser identificado por alguma mudança, pela adição de um reagente auxiliar conhecido como indicador. Após a finalização da reação entre a substância e a solução padrão, o indicador deverá produzir uma mudança de cor no líquido que está sendo titulado. Este ponto é chamado de ponto final da titulação. Em um laboratório analítico é essencial manter em estoque soluções de vários reagentes, algumas delas terão concentrações exatamente conhecidas (soluções padrões) e é imperativo que a temperatura de estocagem destas soluções seja a correta.
As soluções padrões são preparadas pesando-se a quantidade de substância apropriada numa balança analítica, dissolve-se um pouco com o solvente apropriado e transfere-se com o auxílio de um funil, à solução para um balão volumétrico de capacidade adequada, tendo o cuidado de não perder a solução. O funil deve ser lavado algumas vezes com um jato do solvente e transferindo-se para o balão. Agita-se a mistura e completa-se o volume até o traço de referência e finalmente homogeneiza-se.
Quando a substância não for facilmente solúvel em água, é aconselhável aquecer o béquer com a substância e um pouco do solvente, ligeiramente e com agitação, até que a substância se dissolva completamente. Em seguida, deixa-se a solução resfriar e depois se transferi com o auxílio do funil para o balão volumétrico. Lava-se o béquer algumas vezes com o solvente, transferindo para o balão. Em nenhuma circunstância o balão pode ser aquecido.
Em alguns casos pode ser preferível preparar a solução padrão a partir de soluções concentradas, por diluição apropriada.
As soluções que são relativamente estáveis e não são afetadas pela exposição ao ar podem ser estocadas em frascos de 1litro. Nos trabalhos de grande exatidão, os frascos devem ser de pyrex, ou de outro vidro resistente com tampas esmerilhadas. Para soluções alcalinas os frascos de vidro são substituídos por frascos de polietileno. Deve-se observar que os frascos de vidro são obrigatórios para algumas soluções, por exemplo, iodo e nitrato de prata. Nestes dois casos o vidro deve ser escuro (castanho).
Os frascos de estocagem devem estar limpos e secos. Eles devem ser lavados com um pouco da solução, esgotando-se o líquido, enchendo-se os frascos e fechando-os imediatamente. Se o frasco estiver limpo, porém, molhado, deve-se lavá-lo sucessivamente com três pequenas parcelas da solução, esgotando-se completamente o líquido depois de cada lavagem. Depois se enche o frasco com a solução e rotulá-o com o nome da solução, concentração, data de preparação e nome do analista. Antes de usá-lo para qualquer análise deve-se homogeneizar a solução.
2. Considerações sobre reações químicas
Para uma reação ser utilizada em uma titulação, ela deve satisfazer as seguintes condições:
- Deve ocorrer uma reação simples que possa ser expressa por uma equação química.
- A substância a ser utilizada deverá reagir completamente com o reagente em proporções estequiométricas.
- A reação deve ser rápida. Em alguns casos, deve-se adicionar um catalisador para acelerar a reação.
- Deve haver uma mudança de energia livre marcante conduzindo a alteração de alguma propriedade física ou química do soluto no ponto de equivalência.
- Deve haver um indicador específico que defina nitidamente o ponto final da reação.
3. Considerações sobre hidróxido de sódio
Para preparar soluções padrões alcalinas, o reagente mais usado é o hidróxido de sódio. No entanto, este reagente não é padrão primário, porque é higroscópio e sempre contém uma quantidade indeterminada de água e carbonato de sódio adsorvida no sólido. O carbonato de sódio pode ser completamente removido quando se prepara uma solução saturada de NaOH, a qual é deixada em repouso por 24horas. O carbonato de sódio precipita por ser pouco solúvel na solução. Isto significa que as soluções de NaOH devem ser padronizadas com um reagente padrão primário, por exemplo o biftalato de potássio, para poder determinar a concentração real da solução.
As soluções de hidróxido de sódio atacam o vidro e dissolvem a sílica com formação de silicatos solúveis. A presença de silicatos solúveis causa erros e as soluções de hidróxidos devem ser conservadas em frascos de polietileno.
4. Considerações sobre padrão primário
Para uma substância ser considerada padrão primária, ela deve apresentar as seguintes características:
- Fácil obtenção, purificação e secagem;
- Deve existir teste qualitativo simples para identificação de contaminantes, que se presentes devem estar em pequena porcentagem;
- Deve possuir massa molecular elevada (para diminuir o erro de pesagem);
- Solúvel nas condições experimentais;
- Deve reagir com a espécie de interesse de modo estequiométrico e instantâneo;
- Deve manter-se inalterada ao ar durante a pesagem. Não pode ser higroscópica, oxidada ou afetada pelo CO2.
As soluções de hidróxido de sódio são geralmente padronizadas com hidrogenoftalato de potássio ou biftalato de potássio [HKC6H4(COO)2], que é um padrão primário.
5. Objetivos
Esta aula tem como objetivos treinar a técnica de pesagem, ilustrar as técnicas de preparação e padronização de solução aquosa de hidróxido de sódio 0,1mol/L para posteriormente determinar a acidez de uma amostra de vinagre.
6. Materiais
| · Espátula | · Balança analítica e semi-analítica |
| · Béquer de 50 e 100 mL | · Frascos de plástico para acondicionar a solução |
| · Bastão de Vidro | · Béquer de 300mL com água destilada recém fervida |
| · Balão volumétrico de 250 mL | · Bureta de 50 mL |
| · Erlenmeyer de 250mL | · Proveta de 50mL |
| · Béquer de 1000 mL | · Agitador e barra magnética |
7. Reagentes
| · Hidróxido de sódio P.A. | · Biftalato de potássio seco a 105ºC |
| · Fenolftaleína 1% |
Procedimento experimental
8.1. Preparação da solução NaOH 0,1 mol/L
Calcule a quantidade de hidróxido de sódio necessária para se preparar 250mL de solução (massa molecular = 40,0 g/mol). Com o auxílio de um béquer de 100mL, pese numa balança semi-analítica a quantidade de hidróxido calculada. Dissolva com 50mL de água destilada recém fervida e transfira quantitativamente para um balão volumétrico de 250mL. Lave o béquer com pequenos volumes de água destilada, transfira para o balão e finalmente complete o volume com água destilada recém fervida e homogeneíze. Após preparação, junte todas as soluções preparadas pelos diferentes grupos num béquer de 1L, para posterior padronização.
8.2. Padronização da solução de NaOH 0,1 mol/L
Calcule a massa de biftalato de potássio necessária para reagir completamente com 25,00mL da solução de NaOH 0,1mol/L. Pese numa balança analítica exatamente a massa calculada e transfira quantitativamente para um erlenmeyer de 250mL. Meça numa proveta 50mL de água destilada fria e recém fervida e transfira para o erlenmeyer, para dissolver completamente o biftalato de potássio. Adicione duas gotas de fenolftaleína 1% e homogeize.
Lave uma bureta de 50mL com pequena quantidade da solução de NaOH 0,1mol/L. Fixe a bureta de 50mL no suporte universal. Feche a torneira de controle de escoamento. Com auxílio de um béquer de 50mL, encha a bureta com solução de NaOH 0,1 mol/L e observe se há vazamento. Verifique se há bolhas entre a torneira e a extremidade inferior da bureta. Caso tenha, abra a torneira rapidamente até removê-la. Em seguida, encha a bureta com NaOH 0,1mol/L e acerte o menisco com o traço de aferição (zero), que fica na parte superior. Monte o sistema de agitação magnética.
Titule com a solução recém preparada de NaOH 0,1M, até mudança de coloração do indicador de incolor para rosa. Anote o volume gasto e calcule o fator de correção, utilizando a seguinte fórmula.
ou
m = massa do biftalato de potássio pesada; V = volume gasto da solução de NaOH (mL)
M= molaridade da solução (0,1mol/L) 0,2042 = mmol do biftalato de potássio
Calcule a média dos fatores de correção da turma. Em seguida, calcule a concentração real da solução de NaOH 0,1M, multiplicando-se pelo fator de correção.
Finalmente, transfira as soluções de NaOH 0,1 mol/L para frascos de plásticos e escreva no rótulo o nome da solução, concentração, data, fator de correção e turma.
- Referências
Baccan, N.; Andrade, J. C. ; Godinho, O. E. S.; BARONE, J. S. Química Analítica Quantitativa Elementar, 2a edição. Campinas: Editora da UNICAMP, 1995.
SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de Química Analítica. Tradução Marco Tadeu Grassi. Revisão Técnica Célio Pasquini. São Paulo: Pioneira Thomson Learning, 2006.
Ohlweiler, O.A. Química analítica quantitativa. 3a edição. Volume 2. Rio de Janeiro: Livros Técnicos e Científicos, 1981.
VOGEL, A.I. Análise Química Quantitativa. 5a. edição. Rio de Janeiro: Livros Técnicos e Científicos, 1992.
CONDUTIBILIDADE ELÉTRICA
RESUMO
As substâncias químicas são caracterizadas por várias propriedades físicas- químicas, como ponto de fusão, ponto de ebulição, solubilidade, densidade e condutibilidade elétrica.
Quanto a esta última, classificam-nas em condutoras, más condutoras e isolantes elétricas e podem ser usadas para explicar conceitos de ligações químicas entre os elementos que as compõe e os processos de ionização e dissociação iônica.
Assim, um simples experimento de condução elétrica montado com um sistema de três lâmpadas foi proposto como atividade investigativa.
Os resultados da condução elétrica de substâncias iônicas, moleculares e metálicas levaram os alunos a investigar os motivos pelos quais a eletricidade é transmitida, relacionando com as ligações químicas e processos de ionização e dissociação iônica.
INTRODUÇÃO
A condutibilidade elétrica é uma das diversas propriedades físico-químicas das substâncias químicas e é explicada pela transferência de elétrons a partir da formação de íons. Esta característica é importante para classificar os materiais através do grau de condução da eletricidade (PERUZZO, 2006).
Assim, muitas das propriedades dos materiais são explicadas a partir do conhecimento da estrutura da matéria. Ligações iônicas, covalentes e metálicas determinam o comportamento da condutibilidade elétrica das substâncias iônicas, moleculares e metálicas, respectivamente.
De mesma maneira, é relevante entender o comportamento dos materiais quando dissolvidos em água, cujas ligações químicas podem, ou não, gerar íons pelo processo de ionização nas substâncias moleculares, e dissociação iônica nos compostos iônicos, como proposto por Arrhenius (PERUZZO, 2006).
Logo, o experimento de condutibilidade elétrica tem importância por permitir investigar a natureza elétrica da matéria, explicar a existência e a transferência de elétrons através das ligações químicas e a possível geração de íons em soluções aquosas das substâncias. E tem o objetivo de demonstrar para os alunos que estudar ligações químicas é fundamental para ter conhecimento sobre as propriedades físico- químicas das substâncias, observar que há substâncias sólidas, líquidas e aquosas capazes de conduzir corrente elétrica, e analisar o comportamento elétrico dos materiais para classificá-los em condutores, maus condutores e isolantes.
DESENVOLVIMENTO
Para aferir a condutibilidade elétrica de algumas substâncias, pois apresentavam conhecimento prévio dos modelos atômicos de Rutherford e Bohr.
Este experimento está previsto no caderno do aluno (2º série, volume 1), cuja apresentação do sistema de três lâmpadas e dois eletrodos livres na extremidade é feita para conhecimento de como é o teste de condutibilidade elétrica, assim como todo os materiais necessários para sua realização (figura 1) (SÃO PAULO, 2014-2017).
Na primeira aula dupla, foi investigado como testar a condutibilidade elétricas dos materiais iônicos, moleculares e metálicos, definindo a utilização de um sistema com 3 lâmpadas de potências de 2,5, 10 e 60 W para aferir o grau de condução de eletricidade das substâncias, como foi retratado por aluno (figura 2). T
ais lâmpadas estavam ligadas em paralelo e encaixadas em um suporte de madeira. O sistema estava ligado através de um fio com tomada e chave, e seu circuito era aberto com 2 eletrodos, cuja função era colocá-los em contato com a substância a ser analisada, executando o experimento a partir do acendimento, ou não, das lâmpadas. Também, para demonstrar a baixa condução elétrica de algumas substâncias moleculares, as lâmpadas de 10 e 60 W foram desconectadas do sistema e a aferição foi feita apenas com a lâmpada de 2,5 W.
Nesta atividade, os alunos confirmaram a condução de eletricidade com o acendimento das lâmpadas das substâncias sal de cozinha em solução aquosa e metais, a não condutibilidade elétrica de materiais isolantes (sal de cozinha e açúcar no estado sólido, madeira, plástico e borracha) e se surpreenderam com o acendimento da lâmpada de 2,5 W quando foram testadas as substâncias: açúcar no estado aquoso, álcooletílico92°GL, água desmineralizada, água potável e vinagre, que são más condutoras.
Também, puderam detectar a ionização e dissociação iônica que a água causou nas substâncias iônicas e moleculares, respectivamente.
Assim, houve consenso de que para acontecer a condução de eletricidade, deve haver íons livres que transferem as cargas elétricas e fecham o sistema para acendimento das lâmpadas. Para descobrir explicações para os casos em que somente há o acendimento da lâmpada de 2,5W, houve pesquisa bibliográfica cada caso de condutibilidade elétrica.
Figura 2 – Sistema de 3 lâmpadas diferentes potências utilizado no experimento e sua representação registrada por aluno.
Em seguida, definiu-se quais substâncias iônicas, moleculares e metálicas teriam sua condutibilidade elétrica aferida:
- Substâncias iônicas: sal de cozinha no estado sólido e em solução aquosa, e soda cáustica comercial (hidróxido de sódio impuro) com excesso de umidade e também após aquecimento;
- Substâncias moleculares: açúcar no estado sólido e em solução aquosa, álcool etílico 92° GL, água desmineralizada, água potável, ácido clorídrico (4 mol/L), vinagre, madeira, borracha e óleo de cozinha;
- Substâncias metálicas: pedaços de ferro, cobre e alumínio.
E juntamente com os alunos, definiu-se o uso de copos plásticos para acondicionar cada uma das substâncias, sendo empregadas em quantidades suficientes para contato dos eletrodos distantes 2 cm.
Para fazer as soluções aquosas, usou-se água desmineralizada, uma espátula da substância teste e bastão de vidro (para diluição e homogeneização da solução).
Para obter soda cáustica com excesso de umidade, armazenou-se uma pequena porção (uma colher de café) em um copo plástico dentro de uma panela com água e tampada durante 30 minutos.
Para o aquecimento da soda cáustica comercial, estabeleceu-se utilizar o sistema tripé, tela refratária e lamparina com álcool, béquer e pinça de madeira. Também, foi utilizado um copo com água e flanela para limpar os eletrodos a cada teste de substância (Figura3).
As substâncias moleculares madeira, borracha e óleo de cozinha não foram testadas em solução aquosa pois os alunos têm a vivência de que tais substâncias não se dissolvem em água. Logo, já tem o conceito de que não sofrem ionização.
Com o conhecimento prévio de como aconteceria o experimento, os alunos foram divididos em grupos de 4 e 5 integrantes para desenvolvimento de toda a atividade, que está presente no caderno do aluno de Química, 2° série. E iniciou-se com a questão problema:
Qual a substância capaz de conduzir corrente elétrica? Qual lâmpada acenderá? Justifique.
E foram feitas as hipóteses pelos grupos de alunos a partir da questão problema. A maioria dos grupos retratou esses dados em tabela. Observou-se dificuldade dos alunos em saber o grau de ionização e dissociação iônica das substâncias moleculares e iônicas, ocorrendo debate sobre quais lâmpadas acenderiam. Isto também foi visto para a condução elétrica da água desmineralizada e água potável, soda cáustica com excesso de umidade e após aquecimento. Para outras substâncias, os alunos tiveram facilidade para definir as hipóteses como das metálicas e moleculares.
No final da atividade, foi feito um agrupamento das hipóteses na lousa e verificou-se o consenso e as divergências entre os grupos, de mesma maneira com as respectivas justificativas para as hipóteses diferentes, relacionando os elementos químicos da composição das substâncias aos tipos de ligações e à ionização e dissociação iônica. O resgate de informação de aulas anteriores propiciou encontrar o resultado esperado de acordo com o da literatura.
A tabela 1 mostra as hipóteses majoritárias das turmas, cujos resultados esperados são das discussões em grupo. O realce, amarelo, faz referência às hipóteses equivocadas dos alunos.
Tabela 1 – Hipóteses dos alunos em relação à condutibilidade elétrica de substâncias.
| Substâncias | Conduzirá eletricidade? | Qual lâmpada acenderá? | Justifique. |
| Sal de cozinha no estado sólido | Não | Nenhuma | Não há íons livres, pois estão presos na sua estrutura cristalina. |
| Sal de cozinha em solução aquosa | Sim | Todas | Dissociação iônica do sal e geração de íons livres na solução. |
| Soda cáustica comercial comexcesso de umidade | Não | Nenhuma | Os íons estão presos como o sal de cozinha |
| Soda cáustica comercial após aquecimento | Não | Nenhuma | Os íons estão presos como o sal de cozinha |
| Açúcar no estadosólido | Não | Nenhuma | A substância é molecular, há somente compartilhamento de elétrons entre os átomos |
| Açúcaremsoluçãoaquosa | Não | Nenhuma | Não gerará íons pois é substânciamolecular |
| Álcooletílico 92° GL | Não | Nenhuma | Não tem íons livres pois álcool apenas tem ligação covalente |
| Águadesmineralizada | Não | Nenhuma | Somente há moléculas de água |
| Águapotável | Sim | 2,5 W | Poucos íons de sais dissolvidos |
| Ácidoclorídrico (4 mol/L) | Não | Nenhuma | Substância moleculare nãotem íonlivre |
| Vinagre | Não | Nenhuma | Não há íons livres porque há compartilhamento de elétrons |
| Madeira | Não | Nenhuma | É material isolante |
| Borracha | Não | Nenhuma | É material isolante |
| Óleo | Não | Nenhuma | Não há íons livres pois somente ocorre ligações covalentes entre C, H eO. |
| Ferro | Sim | Todas | Transferência de íons livres |
| Alumínio | Sim | Todas | Transferência de íons livres |
| Cobre | Sim | Todas | Transferência de íons livres |
Na segunda aula dupla, ocorreu a verificação das hipóteses, cuja experiência foi feita por cada grupo, sendo acompanhado pela professora, e os resultados obtidos foram registrados para posterior comparação com as hipóteses. Entre um teste e outro para aferição da condução elétrica, os eletrodos foram limpos para não ocorrer contaminação. Também, para as substâncias capazes de acender a lâmpada de 2,5 W, as lâmpadas de 10 e 60 W foram desconectadas dosistema.
Assim, elaborou-se a tabela 2 que contém os resultados obtidos por todos os grupos.
Tabela 2 – Resultados de condutibilidade elétrica das substâncias.
| Substâncias | Condução de eletricidade | Lâmpadasacesas |
| Sal de cozinha no estado sólido | Não | Nenhuma |
| Sal de cozinha em solução aquosa | Sim | Todas |
| Soda cáustica comercial com excesso de umidade | Sim | Todas |
| Soda cáustica comercial após aquecimento | Não | Nenhuma |
| Açúcar no estadosólido | Não | Nenhuma |
| Açúcaremsoluçãoaquosa | Sim | 2,5 W |
| Álcooletílico 92° GL | Sim | 2,5 W |
| Águadesmineralizada | Sim | 2,5 W |
| Águapotável | Sim | 2,5 W |
| Ácido clorídrico diluído (4 mol/L) | Sim | Todas |
| Vinagre | Sim | 2,5 W |
| Madeira | Não | Nenhuma |
| Borracha | Não | Nenhuma |
| Óleo | Não | Nenhuma |
| Ferro | Sim | Todas |
| Alumínio | Sim | Todas |
| Cobre | Sim | Todas |
Na aferição da soda cáustica comercial com excesso de umidade, os alunos perceberam que ocorria o acendimento instável das 3 lâmpadas. Depois, com o aquecimento desta substância, alguns alunos observaram a condensação da água nas paredes do béquer e já relacionaram com a ionização da substância pela água presente na superfície, provocando a condução de eletricidade instável no teste anterior (figura 4). Assim, puderam perceber o equívoco de comportamento igual entre soda cáustica com excesso de umidade e após aquecimento, pois, sem água, não ocorreria à condutibilidade elétrica no teste posterior.
Figura 4 – Aferição da soda cáustica com excesso de umidade.
É válido ressaltar a curiosidade dos alunos que aproximaram demasiadamente os eletrodos, a fim de observar que é até possível o ar conduzir eletricidade pela diferença de potencial (figura 5).
Figura 5 – Curiosidade de aluno para condução elétrica sem geração de faiscamento.
Nesta atividade, os alunos confirmaram a condução de eletricidade através acendimento das lâmpadas utilizando substâncias como o sal de cozinha em solução aquosa e metais e não condutibilidade elétrica de materiais isolantes como sal de cozinha e açúcar no estado sólido, madeira, plástico e borracha.
Através da atividade puderam detectar a ionização e dissociação iônica que a água causou nas substâncias iônicas e moleculares, respectivamente. Assim, houve consenso de que para acontecer à condução de eletricidade, deve haver íons livres que transferem as cargas elétricas em um sistema fechado para acendimento das lâmpadas. Para descobrir explicações para os casos em que somente há o acendimento da lâmpada de 2,5W, houve uma pesquisa bibliográfica.
Na terceira aula dupla, os estudantes realizaram uma pesquisa bibliográfica, com o objetivo de elaborar as justificativas de condutibilidade elétrica das substâncias, com maiores detalhes. E o resultado foi satisfatório para conclusão do experimento, inclusive com imagens sobre a propriedade físico-química da condutibilidade elétrica, melhorando o entendimento.
Para conclusão, os alunos descreveram que as substâncias iônicas no estado sólido não conduzem corrente elétrica, pois seus íons estão imóveis em uma estrutura, chamada retículo cristalino, mantido através das forças de atração eletrostática. Somente no estado aquoso, há liberdade de cargas elétricas capazes de transmitir a corrente elétrica (PERUZZO, 2006).
Para a soda cáustica, que no aquecimento revelou a presença de água (condensação na parede interna do béquer), caracterizou-se como higroscópica, istoé, tem a capacidade de adsorver água que está presente no ar. Assim, há condução instável de eletricidade devido à presença desta pequena quantidade de água capaz de ionizar a soda cáustica. Logo, com o aquecimento, a ausência de água a tornou incapaz de transmitireletricidade.
Para substâncias moleculares que acenderam a lâmpada de 2,5 W, foi explicada pela baixa taxa de ionização. Para o álcool, isso ocorre quando, em poucas moléculas, o átomo de hidrogênio de sua função orgânica se desprende, quebrando a ligação covalente, gerando o caráter ácido, obtendo poucos íons hidroxônio (H3O+) e alcóxido (RO-), e resultando na pequena condução elétrica (KOTZ, 2005). De mesma maneira para o vinagre, que é uma solução diluída de ácido acético, cujo átomo de
hidrogênio liberado é de sua função orgânica.
No teste da água potável, a pequena quantidade de íons (cloretos, nitratos, fluoretos, bicarbonatos, íons de cálcio, bário, sódio, entre outros), justificou o acendimento da lâmpada de 2,5 W. Assim ocorreu para a água desmineralizada, primeiramente, houvedescoberta de sua composição, que somente contem a
substância água (através de processo de remoção de todos os íons por osmose reversa e evaporação/condensação) e depois, informações de geração de íons pela sua auto-ionização, que é a geração de pequenas quantidades de íons H3O+ e hidroxila (OH-). De mesma maneira, esclareceram o resultado da aferição da solução deáguaeaçúcar,pois,mesmocomadissoluçãodasubstânciamolecular,ocorrea
auto-ionização da água (GEPEQ, 2006).
Logo, o motivo pelo qual há o acendimento da lâmpada de 2,5W é a baixa corrente elétrica que esta solução gera, sendo suficiente para acendê-la. Outras lâmpadas, com potências maiores exigem maior corrente, não acendendo nesta solução de poucos íons.
Já para o ácido clorídrico, há alta taxa de ionização e formação de muitos íons em solução, H3O+ e cloreto (Cl-), o que justifica acender todas as lâmpadas.
Para as outras substâncias moleculares, a madeira, borracha e óleo, a não condução elétrica foi justificada através da sua composição (predominância de carbono, hidrogênio e oxigênio) e consequentes ligações covalentes, isto é, compartilhamento de elétrons.
Os metais foram as substâncias de maior facilidade de entendimento para os alunos porque além do conhecimento prévio e do cotidiano, eles já tinham o conceito de transferência direta de elétrons como uma nuvem eletrônica, pois são doados para o conjunto cristalino e não pertencem a nenhum átomo em especial, ou seja, cada átomo doa espontaneamente as cargas negativas uns aos outros.
CONSIDERAÇÕES FINAIS
O experimento de condutibilidade elétrica das substâncias iônicas, moleculares e metálicas obteve resultado satisfatório para enfatizar os conceitos de ligações químicas e propriedade físico-química da matéria. A aplicação da metodologia de investigação levou os alunos a pensarem em resultados esperados e, depois do experimento, a confirmar e/ou se questionar sobre os equívocos cometidos na elaboração das hipóteses.
Então, quando os alunos puderam comparar os resultados obtidos diferentes das hipóteses, pesquisando sobre a substância, a predominância de qual tipo de ligação química e/ou seu comportamento em água, houve o aprendizado.
Da mesma maneira, a percepção da construção do conhecimento foi notável quando os alunos começaram a encontrar justificativas de seus acertos, escrevendo com maiores detalhes o motivo da ocorrência da condutibilidade elétrica. Paraos erros, foi evidente o esforço dos estudantes para descobrir explicações, através de
conhecimentos científicos. Realmente, eles conseguiram superar a impaciência da resolução e a atividade foi completa.
Portanto, é válido conceber que a proposta da Metodologia do Programa ABC na Educação Científica – Mão na Massa é inovadora porque os alunos interagem em grupos para adquirir conhecimento de maneira investigativa que através de uma questão problema, realizam a elaboração de hipóteses e a investigam por meio do experimento. Para o professor, esta atividade proporciona dar autonomia aos alunos para pensar, sugerir, questionar e buscar o conhecimento.
REFERÊNCIAS
Kotz, John C. Química Geral e reações químicas, volume 1, 5ª edição. Tradução técnica Flávio Maron Vichi. Editora Pioneira Thomson Learning, São Paulo. 2005.
Peruzzo, F.M.; Canto, E.L., Química na abordagem do cotidiano, volume 1, 4ª edição, editora Moderna, São Paulo, 2006.
SÃO PAULO, Caderno do Professor, Ensino Médio, 2ª série, Química, volume 1. Nova Edição 2014-2017. Material de Apoio ao Currículo do Estado de São Paulo.
GEPEQ. Química e a Sobrevivência: Hidrosfera – Fonte de Materiais.Volume 4, 1ª edição. Editora da USP, São Paulo, 2006.
Processo de eletrólise
COBREAÇÃO
Introdução:
A eletrólise é uma reação de oxirredução não espontânea que é iniciada pela passagem de corrente elétrica em um meio em que os íons estejam livres. Isso pode ser conseguido por meio da fusão de substâncias iônicas (eletrólise ígnea) ou sendo feita em meio aquoso (eletrólise aquosa).
Entre outras aplicações, a eletrólise é muito usada para revestir peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
A galvanoplastia reveste a peça, colocando-a como o cátodo em um circuito de eletrólise. Já a eletrólise de purificação é um tratamento metalúrgico do minério. O mais utilizado na indústria é a purificação do cobre, que pode ser vista com mais detalhes no texto “Eletrólise com Eletrodos Ativos” .
Esse efeito é conseguido resumidamente porque o cobre metalúrgico de uma placa funciona como o ânodo, liberando cátions que migram e se depositam sobre o outro polo, à medida que a corrente elétrica passa.
Nesse experimento iremos fazer uma cobreação, é o nome dado à galvanização de um metal realizada com Cobre. em que revestiremos uma chave de cobre. Esse experimento também pode ser feito com outros materiais feitos de metal, como moedas, parafusos.
Objetivo:
Mostrar uma das possíveis aplicações da eletrólise, identificando as reações envolvidas.
Materiais e reagentes:
- Bateria conectada a dois fios de cobre (o fio também pode ser conectado a uma placa de cobre, como mostrado nos objetos da imagem abaixo);
- Solução aquosa de sulfato de cobre (CuSO4);
- Frasco transparente (pode ser um copo ou um béquer);
- Uma chave.
Procedimento experimental:
- Coloque no frasco transparente a solução de sulfato de cobre;
Prenda a chave a um dos fios que saem da bateria;
3. Mergulhe-a na solução;
4. Coloque a ponta do outro fio na solução. Se você tiver um fio conectado na placa, mergulhe essa placa na solução;
5. Anote o que é observado tanto na cor da chave, como na cor da solução.
Resultados e Discussão:
A partir do que foi realizado e das explicações dadas em sala de aula sobre o conteúdo de eletrólise, o professor pode explorar dos alunos aspectos como: quem foi o cátodo, quem foi o ânodo, qual era o papel da solução aquosa de sulfato de cobre, quais foram as semirreações envolvidas, qual é a reação global, entre outros pontos relacionados.
A eletrólise é um processo em que se passa uma corrente elétrica sobre uma substância e, por meio de reações de oxirredução, o composto decompõe-se. Se a substância estiver no estado líquido (fundida), temos uma eletrólise ígnea, mas se estiver em solução aquosa, temos uma eletrólise em meio aquoso.
Materiais
a) 1 fonte de corrente contínua de 15V;
b) 2 conectores com bico de jacaré;
c) 1 frasco transparente;
d) 1 chave;
e) Sulfato de Cobre (CuSO4) concentração de 0,5 mol/L.
Procedimentos
Colocou-se no frasco transparente 55mL da solução de Sulfato de Cobre. Em seguida, com auxílio do conector com bico de jacaré, prendeu-se a chave ao pólo negativo da fonte de corrente contínua de 15V e introduziu-o na solução.
Logo após, usou o outro conector com bico de jacaré para ligá-lo ao pólo positivo da fonte de corrente contínua de 15V e introduziu-o na solução.
Ligou-se a fonte de corrente contínua e baixou-se a voltagem para evitar que o recipiente estourasse, deixou-se a chave imersa na solução por 10 minutos.
Passado o tempo,retirou-se a chave da solução e verificou-se os resultados.
Procedimento Experimental:
• Ligamos o fio de cobre na bateria;
• Em seguida, colocamos uma moeda presa ao lado preto do fio;
• Mergulhamos os fios em uma solução de CuSo4 . 5 H2O;
•Assim, a moeda foi mudando de cor, ficando cobreada;
• O cobre sofreu redução, liberando gás oxigênio;
• Determinamos que a solução formada na equação global, era ácida após colocarmos o papel de tornassol e observarmos que ele ficou de coloração rosa.
Esquema:
Resultados:
CuSO4 → Cu+² + SO4-²
2H2O → 2H+ + 2OH- (x2)
Cu+² + 2e → Cu (redução;cátodo (-))
2OH → H2O + ½ O2 + 2e (oxidação; ânodo; (+))
➢ Equação global
CuSO4 + H2O → 2H+ + SO4-² + Cu + ½O2
ELETRÓLISE DO CLORETO DE SÓDIO
A eletrólise do cloreto de sódio na forma ígnea produz gás cloro e sódio, já a eletrólise do sal em meio aquoso produz os gases cloro, hidrogênio e soda cáustica?
A eletrólise é um processo em que se passa uma corrente elétrica sobre uma substância e, por meio de reações de oxirredução, o composto decompõe-se. Se a substância estiver no estado líquido (fundida), temos uma eletrólise ígnea, mas se estiver em solução aquosa, temos uma eletrólise em meio aquoso.
Uma das eletrólises de maior importância comercial é a do cloreto de sódio (NaCl), o sal de cozinha.
* Eletrólise ígnea do cloreto de sódio:
A eletrólise ígnea do sal produz o gás cloro (Cl2) e o sódio metálico (Na), substâncias que não são encontradas na natureza nessa forma. O sal funde-se a uma temperatura aproximada de 800ºC e, no estado líquido, o NaCl sofre disssociação, produzindo os seguintes íons:
NaCl → Na+ + Cl–
Na eletrólise ocorre a passagem da corrente elétrica segundo o esquema a seguir:
Esquema de processo de eletrólise ígnea do cloreto de sódio (sal de cozinha)
O polo negativo da bateria fornece elétrons para um dos eletrodos, que se torna o cátodo ou polo negativo.
Visto que ele é negativo, ele atrai os cátions Na+ que estão no líquido. Esses íons recebem os elétrons do cátodo e, nesse eletrodo, ocorre a seguinte semirreação de redução:
Semirreação no cátodo: redução: Na+(l) + e– → Na(s)
Nesse eletrodo foi formado o primeiro produto, que é o sódio metálico.
Por outro lado, o outro eletrodo torna-se o ânodo, pois está carregado positivamente, atraindo os ânions Cl–, que perderão seus elétrons, sofrendo oxidação:
Semirreação no ânodo: oxidação: 2Cl–(l) → 2 e– + 1Cl2(g)
Esse gás cloro fica borbulhando ao redor do ânodo, como mostra a reação a seguir. Ele é coletado por meio de um tubo de vidro adaptado ao sistema:
Esquema de processo de eletrólise do cloreto de sódio (sal de cozinha)
Assim, a reação global da eletrólise ígnea do sal é:
Cátodo: Na+(l) + e– → Na(s)
Ânodo: 2Cl–(l) → 2 e– + 1Cl2(g)____________
Reação Global: Na+(l) + 2Cl–(l) → Na(s) + 1Cl2(g)
Gás cloro e sódio metálico – produtos da eletrólise ígnea do sal de cozinha
* Eletrólise aquosa do cloreto de sódio:
Nesse caso, além da dissociação iônica do NaCl, formando os íons Na+ e Cl–, existe também a reação de autoionização da água, conforme a equação a seguir:
2 H2O(l)→ 1 H3O+(aq) + OH1-(aq)
Então, surgem as dúvidas: Qual cátion será descarregado primeiro no cátodo, o Na+ou o H3O+? E no ânodo, o Cl– ou o OH– será descarregado primeiro?
Basicamente, podemos dizer que o íon menos reativo será o que descarregará em cada eletrodo.
O texto Eletrólise em meio aquoso explica detalhadamente como verificar qual é o cátion ou o ânion menos reativo e determinar como ocorre a eletrólise.
Entre o Na+ e o H3O+, o Na+ é um metal alcalino, sendo mais reativo. Por isso, a água recebe os elétrons do cátodo:
Semirreação no cátodo: 2 H+ + 2e– → H2
Agora, no caso dos ânions, o Cl– é menos reativo que o OH– e, por isso, sofre oxidação:
Semirreação no ânodo: 2 Cl– → Cl2 + 2e–
Veja a reação global dessa eletrólise:
Esquema de processo de eletrólise da salmoura e reação global
Observe que a eletrólise de uma solução aquosa de NaCl produz soda cáustica (NaOH), gás hidrogênio (H2) e gás cloro (Cl2). Em virtude da presença da base NaOH, o meio permanece básico.
Demonstração da chuva ácida
- Introdução:
A chuva ácida é um dos grandes problemas ambientais de aspecto global com que todos se confrontam. Ela tem causado morte de peixes, destruição de vegetações, contaminação do solo e água e degradação de monumentos artísticos, estruturas metálicas, de prédios, edifícios, pontes e outros, além do surgimento de doenças respiratórias.
Portanto, é um tema de imprescindível importância, que precisa ser mencionado em sala de aula. A química está envolvida nesse processo, pois a chuva ácida ocorre devido à grande quantidade de óxidos ácidos poluentes, que são lançados na atmosfera e, que, posteriormente, reagem com a água da chuva produzindo ácidos.
Os principais óxidos que tornam a chuva ácida são os óxidos de enxofre (SO2e SO3), que podem vir de diversas fontes, tais como erupções vulcânicas e decomposição de restos de animais e vegetais. No entanto, a concentração desses gases na atmosfera está atingindo níveis alarmantes porque a combustão de uma grande quantidade de combustíveis fósseis libera enxofre na forma de seus óxidos. Por exemplo, os combustíveis fósseis usados em indústrias, como o carvão mineral; e em automóveis, como derivados do petróleo, principalmente o óleo diesel.
- Objetivo:
O objetivo é demonstrar a transformação da matéria na qual ocorrem mudanças qualitativas na composição química de uma ou mais substâncias reagentes, resultando em um ou mais produtos.
- Conceitos:
O dióxido de enxofre pode reagir com o oxigênio do ar e se transformar no trióxido de enxofre, que se dissolve na água da chuva tornando-se ácido sulfúrico: O dióxido de enxofre é produzido pela queima de óleo diesel por caminhões e ônibus e de combustíveis fósseis, como o carvão e os derivados de petróleo. Ao atingirem a superfície terrestre sob a forma de chuva, geada, neve ou neblina, esses ácidos alteram a composição do solo e das águas, comprometendo as lavouras, as florestas e a vida aquática. Também podem corroer edifícios, estátuas e monumentos históricos.
Os óxidos de enxofre, eles reagem com a água e formam o ácido sulfúrico, o mesmo ácido usado em baterias de automóveis, que é um ácido muito forte:
O odor é Tóxico cuidado desses gases são provenientes principalmente da queima de combustíveis fósseis em indústrias e em veículos automotivos.
Enxofre é encontrado na forma sólida de símbolo S
Ele entra em combustão na presença do Oxigênio gasoso O2. A mudança de odor que acontece é uma combustão, a equação da reação de combustão de enxofre e a reação do gás produzido com a água:
S(s) + O2(g) → SO2(g)
O dióxido de enxofre reage com água formando o ácido sulfuroso
SO2(g) + H2O(l)→ HSO3(aq) (Ácido sulfuroso)
SO2(g)+ ½ O2(g) → SO3(g)
SO3(g) + H2O(l)→ H2SO4(aq) (Ácido sulfúrico)
Toda chuva é naturalmente ácida (pH< 7), pois a água reage com o gás carbônico (CO2) presente na atmosfera e forma o ácido carbônico (H2CO3). Assim, a chuva tem um pH de cerca de 5,6.
Esse problema agrava-se ainda mais com a presença de óxidos de nitrogênio na atmosfera, que reagem com a água da chuva, formando o ácido nítrico (HNO3) e o ácido nitroso (HNO2), que, ao longo do tempo, podem causar certo impacto ambiental.
N2(g) + 2 O2(g) → 2 NO2(g)
NO2(g) + H2O(l)→ HNO2(aq) + HNO3(aq)
- Procedimento Experimental:
- Coloque água no pote de vidro até aproximadamente um quinto da sua altura;
- Adicione algumas gotas do indicador fenolftaleína;
- Acrescente algumas gotas de solução de amônia até que a solução mude de cor;
- Com o durex, prenda o cabo da flor em um dos lados do pote de vidro sem encostar na água;
- Do outro lado, você pode prender um papel indicador de pH;
- Entorte a colher para que ela possa ser presa na tampa do pote de vidro.
- Coloque um pouco de pó de enxofre na colher e queime.
- Quando começar a sair uma fumaça, pare de queimar o pó de enxofre e tampe rapidamente o pote de vidro.
Observe o que acontece com a flor com o passar do tempo. Lembre-se de abrir o pote em um lugar bem ventilado para não respirar os gases formados.
Por essa razão, o pH da água da chuva fica muito baixo, cerca de 4,5, o que causa inúmeros estragos ambientais.
O experimento realizado aqui foi uma demonstração em pequena escala dos efeitos da chuva ácida.
É por isso que a flor perde a cor. Olhando a cor do papel indicador de pH e comparando-o com o padrão vindo na sua caixinha, é possível mostrar para os alunos o valor aproximado do pH da “chuva ácida caseira” formada dentro do pote de vidro.
Papel indicador de pH mostrando pH próximo a 4
Indicadores Ácidos Bases Naturais
INTRODUÇÃO:
DEFINIÇÃO DE ARRHENIUS.
Em 1884, Arrhenius definiu um ácido como uma substância contendo hidrogênio que produz íons hidrogênio em solução e uma base como uma substância contendo hidróxido que produz íons hidróxido em solução. A neutralização foi descrita por Arrhenius como a combinação destes íons para formar água:
H+(aq) + OH–(aq) ® H2O
Isto está de acordo com a observação de que quando uma solução diluída de HCl, HBr, HI, HNO3 ou HClO4 é misturada com uma solução diluída de NaOH, KOH, RbOH, Ba(OH)2 ou La (OH)3, o calor de neutralização molar,DHneut, é sempre o mesmo: – 55,90 kJ por mol de água formada (isto é, 55,90 kJ de calor são liberados por mol). Os ácidos acima são todos fortes (completamente dissociados) e as bases são todas fortes, de maneira que, não importa qual par ácido-base escolhido, a reação é a mesma: a combinação de um íon hidrogênio com um íon hidróxido para formar uma molécula de água.
DEFINIÇÃO DE BRONSTED-LOWRY.
Em 1923, Bronsted na Dinamarca e Lowry na Inglaterra, independentemente, sugeriram uma definição ácido-base. A definição de Bronsted-Lowry é uma definição protônica. De acordo com ela, ácido é uma espécie que tende a doar um próton e base é uma espécie que tende a aceitar um próton. Além disso, uma reação ácido-base é uma reação de transferência de prótons. A definição de Bronsted-Lowry é bastante geral em muitos aspectos. O HCl, por exemplo, é um ácido em solução aquosa, de acordo com a definição de Arrhenius. Mas, também, o HCl é um ácido de Bronsted-Lowry em qualquer outro solvente, mesmo quando não está presente nenhum outro solvente. Ele é um ácido simplesmente porque pode doar um próton.
De acordo com a idéia de Bronsted-Lowry, uma reação ácido-base envolve a competição por um próton entre duas bases. Quando, por exemplo, o cloreto de hidrogênio se dissolve em água, uma molécula de HCl (um ácido) doa um próton a H2O (uma base) para formar H3O+ (um ácido) e Cl– (uma base):
HCl(g) + H2O ® H3O+ + Cl–
Ácido1 + base2 ® ácido2 + base2
Prótons (H+) não aparecem explicitamente. Em seu lugar, a equação apresenta um ácido transferindo um próton para uma base formando uma base conjugada e ácido, respectivamente. Na equação acima, HCl e Cl– constituem um par ácido-base conjugados, e H2O e H3O+ são o outro par.
DEFINIÇÃO DE LEWIS.
Uma definição de ácido-base ainda mais abrangente foi sugerida pelo químico americano G.N. Lewis em 1923, mesmo ano em que Bronsted-Lowry fizeram suas proposições. De acordo com Lewis, ácido é uma espécie com um orbital vazio capaz de aceitar um par de elétrons, enquanto base é uma espécie que pode doar um par de elétrons para formar uma ligação covalente coordenada. Em resumo, ácido é um receptor de par de elétrons e base é uma doador de par de elétrons. Toda reação ácido-base de Lewis consiste na formação de uma ligação covalente coordenada.
Descrição
Algumas plantas e flores podem ser utilizadas como indicadores de pH. Um dos mais interessantes é o extrato de repolho roxo, apresenta cores diversas conforme a acidez e a basicidade do meio que se encontra, substituindo (para um menor número de faixas de pH) os papéis de indicadores universais , que só podem ser adquiridos em lojas especializadas e não são disponíveis em todas as regiões do país.
Construção de uma escala de pH.
utilizando repolho roxo
material
14 tubos de ensaio
2 provetas de 10 ml.
1 peneira
1 conta – gotas
1 béquer de 500 ml.
1 bico de Bunsen
reagentes:
solução diluída de ácido clorídrico ou ácido muriático
( 1 ml. do ácido concentrado em água até 100 ml. )
solução de hidróxido – soda cáustica ( uma pastilha de NaOH em 100 ml. de água destilada)
detergente com amoníaco
álcool comum
vinagre branco
repolho roxo
água destilada
Procedimento
Preparação de extrato de repolho roxo
Corte o repolho em pequenos pedaços e coloque-os no béquer com água destilada até cobri-los
Ferva até que a água seja reduzida à metade do volume inicial
Com o auxílio de uma peneira , coe a solução obtida.
Observação: o extrato de repolho roxo deve ser guardado em geladeira ou, de preferência congelado, pois se decompõe com o tempo.
Preparação da escala padrão
Prepare nos tubos de ensaio as soluções da tabela 1
Rotule os tubos com os valores de pH aproximados, de acordo com a tabela 1
As soluções não devem ser guardadas; para poder usá –las como escala padrão de pH, elas devem ser preparadas na hora.
(Os valores aproximados de pH foram medidos em peagâmetro)
Testando o pH
Agora serão testados materiais de uso doméstico para determinar a acidez ou basicidade como:
- xampu
- leite
- suco de limão
- solução de bateria de carro
- detergente líquido
- mistura de água e sabão
- clara de ovo
Coloque em um tubo de ensaio 5 ml. de água destilada e 5 ml. de extrato de repolho roxo. Acrescente a cada tubo cinco gotas do material a ser testado.
Tabela
Resposta
pH de alguns materiais
sangue : 6,5 a 7,3
leite bovino: 6,3 a 6,6
saliva: 6,5 a 7,5
laranja : 3,0 a 4,0
suco de limão : 2,2 a 2,4
vinagre: 2,4 a 3,4
clara de ovos: 7,0 a 8,0
detergente: 6,5 a 7,5
morango: 3,0 a 3,5
banana: 4,5 a 4,


