Organização da Tabela Periódica

Dmitri Ivanovich Mendeleev (1834-1907) foi considerado o “pai da Tabela Periódica”, pois em 1869 ele organizou os elementos químicos em filas horizontais em ordem crescente de massa atômica e mostrou que nas linhas verticais havia elementos com propriedades químicas e físicas semelhantes.
Foi o primeiro trabalho que conseguiu relacionar as propriedades periódicas (que se repetiam em intervalos regulares) dos elementos. Seu trabalho foi tão impressionante que Mendeleiev conseguiu até mesmo prever a existência de determinados elementos que ainda não haviam sido descobertos, onde eles ficariam na Tabela Periódica e quais seriam as suas propriedades.
No entanto, em 1913, o físico inglês Henry Moseley realizou experimentos com raios X e descobriu o número atômico (Z) dos elementos químicos, ou seja, a quantidade de prótons que há no núcleo dos átomos de cada elemento. Ele provou que as propriedades dos elementos tinham relação não com a massa atômica, como dizia Mendeleiev, mas sim com o número atômico.
Por isso, a Tabela Periódica atual é organizada em linhas horizontais em ordem crescente de número atômico. Tanto que o primeiro elemento químico que aparece da esquerda para a direita na parte superior é o hidrogênio, que é o elemento de menor número atômico, 1. Logo à sua direita vem o hélio, He, com número atômico igual a 2, depois vem o lítio, com número atômico igual a 3, seguido do berílio, Be, de número atômico igual a 4, e assim por diante.
Essa classificação crescente de números atômicos permite organizar os elementos em grupos ou famílias (colunas) que possuem propriedades semelhantes, além disso, as linhas horizontais também nos revelam particularidades a respeito dos átomos dos elementos. Observe como se dá essa organização:
- Grupos ou famílias – Colunas:
As colunas são chamadas de grupos ou famílias. Esses nomes são bem apropriados, pois os membros de uma família possuem várias características físicas, emocionais e psicológicas semelhantes; além disso, os membros de um grupo específico possuem também objetivos e gostos similares. Da mesma forma, os elementos pertencentes a um mesmo grupo ou a uma mesma família da Tabela Periódica possuem propriedades físicas e químicas semelhantes.
Isso acontece porque os elementos químicos que estão em uma mesma família possuem a mesma quantidade de elétrons na camada de valência, isto é, na última camada eletrônica:
- Família 1: Possuem todos 1 elétron na camada de valência;
- Família 2: Possuem todos 2 elétrons na camada de valência;
- Família 13: Possuem todos 3 elétrons na camada de valência;
- Família 14: Possuem todos 4 elétrons na camada de valência;
- Família 15: Possuem todos 5 elétrons na camada de valência;
- Família 16: Possuem todos 6 elétrons na camada de valência;
- Família 17: Possuem todos 7 elétrons na camada de valência;
- Família 18: Possuem todos 8 elétrons na camada de valência.
Segundo a IUPAC (União Internacional da Química Pura e Aplicada), atualmente as famílias da Tabela Periódica devem ser ordenadas de 1 a 18. Algumas dessas famílias possuem nomes especiais, que são muito usados:
- Família 1: Metais alcalinos;
- Família 2: Metais alcalinoterrosos;
- Família 16: Calcogênios;
- Família 17: Halogênios;
- Família 18: Gases Nobres.

Organização das famílias da tabela periódica
Ainda hoje existem Tabelas Periódicas que usam a numeração antiga, que usava números acompanhados das letras “A” ou “B”. Essas letras eram usadas para representar mais alguns subgrupos dos elementos, que são: elementos representativos e elementos de transição (externa e interna).
- Elementos representativos: Antigamente eram todos os membros das famílias que tinham o número acompanhado da letra “A” (1A, 2A, 3A, 4A, 5A, 6A, 7A e 8A). Hoje eles estão nas famílias 1, 2, 13 a 18. São os elementos mais importantes da Tabela Periódica e são os mais estudados no Ensino Médio. Todos os elementos representativos possuem o seu elétron mais energético situado nos subníveis “s” ou “p”.
- Elementos de transição: Antigamente eram todos os membros das famílias que tinham o número acompanhado da letra “B” (1B, 2B, 3B, 4B, 5B, 6B, 7B e 8B), mas hoje são os membros das famílias 3 a 12. Esses elementos estão representados na região central da Tabela. Todos os elementos de transição possuem o seu elétron mais energético situado nos subníveis “d” ou “f”.
– Elementos de transição externa: São aqueles que estão expostos regularmente como os demais elementos na Tabela Periódica. Eles estão representados na região central da Tabela. Seus elétrons mais energéticos ficam no subnível “d”.
– Elementos de transição interna: Esses elementos estão abaixo do corpo principal da Tabela e são duas séries: a série dos lantanídeos e a série dos actinídeos. Seus elétrons mais energéticos ficam no subnível “f”.
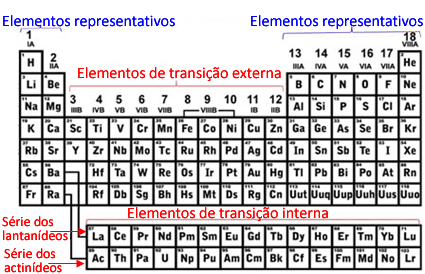
Elementos representativos e de transição na Tabela Periódica
- Períodos – Linhas:
As sete linhas horizontais que aparecem na Tabela Periódica são os períodos e indicam a quantidade de camadas eletrônicas que os átomos de tais elementos possuem. Por exemplo, todos os elementos do primeiro período (primeira linha) da Tabela Periódica possuem apenas uma camada eletrônica, a camada K; enquanto isso, todos os elementos do segundo período têm duas camadas eletrônicas, as camadas K e L, e assim por diante.
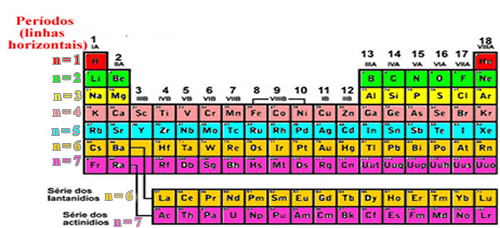
Organização dos períodos da tabela periódica
Por Jennifer Fogaça
Graduada em Química


